Vídeo resumen
Resumen en vídeo de la Guía ELSO de ECMO para la hipotermia accidental.
Introducción

La hipotermia accidental (HA) puede ser causada por la exposición a condiciones climáticas frías, inmersión en agua, sepultura por avalancha en la nieve o en interiores, afectando principalmente a pacientes ancianos con múltiples comorbilidades.
Hay tres etapas de HA.
- En la HA leve, las temperaturas centrales son de 35 °C a 32 °C (95 °F a 89,6 °F) y el estado mental es normal o está levemente deteriorado.
- En la HA moderada con temperaturas centrales entre 32 °C y 28 °C (89,6 °F a 82,4 °F), los pacientes pueden estar inconscientes o conscientes con un estado mental alterado.
- En la HA grave con temperaturas centrales <28 °C (82,4 °F), los pacientes están inconscientes. Los cambios fisiopatológicos causados por la hipotermia afectan el sistema cardiovascular, lo que lleva a arritmias, deterioro del gasto cardíaco y paro cardíaco (PC).
Puede haber morbilidad y mortalidad significativas, pero también puede haber resultados favorables.
Los pacientes con temperaturas centrales <28 °C (82,4 °F) sin AC pueden recalentarse mediante métodos convencionales.
En pacientes inestables, el soporte vital extracorpóreo (ECLS), es decir, oxigenación por membrana extracorpórea (ECMO) o derivación cardiopulmonar, es más eficaz que los métodos convencionales, ya que proporciona soporte cardiorrespiratorio además del recalentamiento.
La oxigenación por membrana extracorpórea también puede utilizarse para proporcionar soporte cardiorrespiratorio posterior al recalentamiento, si es necesario.
La selección de pacientes, la predicción de resultados y el tratamiento dependen de la logística y la planificación, incluida la planificación para la implementación del ECLS.
El riesgo de CA es alto en pacientes jóvenes y sanos con temperaturas centrales <28 °C (82,4 °C) y en pacientes ancianos o pacientes de cualquier edad con comorbilidades y temperaturas centrales <30 °C (86 °F). Estos pacientes deben ser transferidos a centros capaces de proporcionar ECLS.
El estudio ICE-CRASH mostró que el tratamiento con ECMO se asoció significativamente con una mejor supervivencia a los 28 días y resultados neurológicos favorables al alta hospitalaria en pacientes con CA en comparación con los que no recibieron ECMO (odds ratio [OR]: 0,17, intervalo de confianza [IC] del 95 %: 0,05-0,58 y OR: 0,22, IC del 95 %: 0,06-0,81).
Las indicaciones para el recalentamiento con ECLS en pacientes con hipotermia grave con circulación preservada no se han establecido con precisión, y los datos sobre los resultados son contradictorios. En un estudio, la ECMO no mejoró la supervivencia ni los resultados neurológicos, y aumentó la duración del tratamiento y la frecuencia de complicaciones hemorrágicas.
Otros dos estudios hallaron que los pacientes con hipotermia grave e inestabilidad cardiovascular podrían beneficiarse del recalentamiento extracorpóreo sin un mayor riesgo de complicaciones. La tasa de supervivencia fue mayor en los pacientes recalentados con ECLS. El riesgo relativo de muerte fue el doble en los pacientes recalentados por medios menos invasivos.
La elegibilidad para el ECLS no debe basarse únicamente en la temperatura central ni en el estadio de hipotermia, sino también en el estado del paciente.
Esta guía de consenso de expertos de la Organización de Soporte Vital Extracorpóreo (ELSO) brinda recomendaciones para el uso de ECLS para el apoyo cardiorrespiratorio y para el recalentamiento en casos de HA grave.
Preparación y organización
La cadena de supervivencia en la AH comienza en la fase prehospitalaria ( Figura 1 ).
Los pacientes que están inconscientes, tienen una presión arterial sistólica de <90 mm Hg, bradicardia de <40/min o arritmias ventriculares tienen un alto riesgo de CA.
El paro cardíaco puede ser desencadenado por el movimiento del paciente, por el manejo de las vías respiratorias y por otros procedimientos de rescate. La aparición del paro cardíaco hipotérmico (PCH) reduce la supervivencia a la mitad.
El movimiento cauteloso del paciente puede prevenir el PCH. El reconocimiento temprano de la AH como una posible causa de PC y la provisión de reanimación cardiopulmonar (RCP) de alta calidad son esenciales para mejorar la posibilidad de supervivencia. La compresión torácica mecánica es ventajosa porque la RCP puede prolongarse.
La RCP retardada o intermitente es una opción en lugares difíciles o peligrosos, cuando se traslada a un paciente en un centro de atención médica o si no hay suficientes reanimadores disponibles para realizar la RCP continua.
Un transporte de larga duración con RCP continua no debería ser motivo para retener la reanimación.
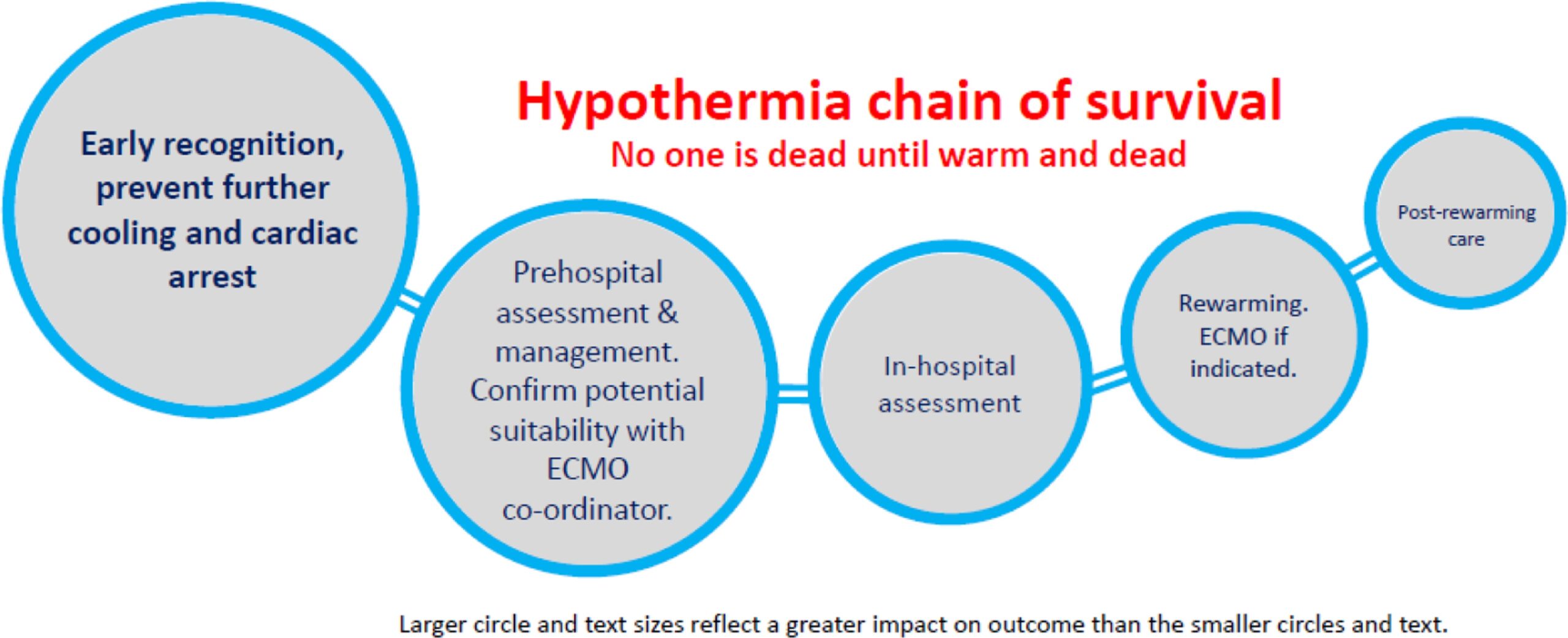
El servicio médico de emergencia (SME) debe notificar al hospital receptor en colaboración con el centro de ECLS mientras el paciente aún se encuentra en el lugar. El centro de ECLS debe estar disponible las 24 horas, los 7 días de la semana, para apoyar a los equipos prehospitalarios.
La cadena de supervivencia de la hipotermia prehospitalaria ilustra la importancia del reconocimiento temprano de la HA, la prevención de un mayor enfriamiento, la monitorización y el traslado al hospital correcto de un paciente con HA ( Tabla 1 ).
La identificación temprana de pacientes en la fase prehospitalaria puede verse afectada por la falta de termómetros para la temperatura central.
| Escenario | Acciones esenciales | Criterios de decisión/Acciones específicas | Equipo necesario |
|---|---|---|---|
| Reconocimiento temprano y decisión de transporte | Evaluar: ¿Es la historia clínica compatible con hipotermia? Evaluar los hallazgos clínicos para identificar candidatos para ECLS . Decidir sobre la necesidad de traslado hospitalario. | Tiempo y lugar: Tiempo estimado de exposición del paciente: fecha, hora de hallazgo, lugar. Circunstancias: Colapso, inmersión, evidencia de enfriamiento, testigos, evidencia de intento de suicidio, consumo de drogas, pérdida repentina del conocimiento. Factores que afectan la velocidad de enfriamiento: Inmersión, tipo de ropa, condiciones climáticas. Contraindicaciones potenciales: Antecedentes de paro cardíaco antes del enfriamiento; avalancha sin vía aérea permeable y enterramiento >60 min; traumatismo mayor; inmersión prolongada. Temperatura central: <30 °C. Nivel de conciencia: P o U en la escala AVPU. Estado cardiorrespiratorio: En paro cardíaco. Tórax compresible. No en paro cardíaco. Presión arterial sistólica <90 mm Hg. Bradicardia <40 latidos/min. Arritmia ventricular. Sin contraindicación absoluta: Ver Figura 2. | Termómetros de lectura baja (esofágicos o epitimpánicos) Presión arterial no invasiva Glucemia ECG Ultrasonido |
| Evaluación y gestión | – Monitorización – Atención al paciente: – Soporte vital avanzado – Protección térmica | Inicie la RCP si es necesario. El paro cardíaco hipotérmico requiere una reanimación prolongada. La RCP continua de alta calidad (preferiblemente, compresión torácica mecánica) es esencial. La RCP intermitente es una opción para periodos cortos en lugares difíciles, cuando el personal de rescate no puede mantener la RCP continua o al mover a un paciente en paro cardíaco. | – Dispositivos de RCP. Dispositivo de compresión torácica mecánica. Desfibrilador. Dióxido de carbono al final de la espiración para confirmar la posición del tubo endotraqueal (pero no para decidir si se debe interrumpir la reanimación). – Dispositivos de monitorización portátiles. – Aislamiento, almohadillas térmicas químicas, calentador de líquidos intravenosos, glucosa intravenosa. |
| Traslado al hospital correcto | – Coordinación con el Centro ECLS y el Centro de Hipotermia – Establecer la logística de transporte. – Atención durante el transporte – Llegada y entrega | – Comunicar el estado del paciente y la necesidad de ECLS: paro cardíaco (S/N); tiempo; retraso en la RCP después del paro; RCP continua o intermitente; compresión torácica mecánica; intentos de desfibrilación, número de veces; fármacos para SVA; manejo de la vía aérea. – Disponibilidad de instalaciones con capacidad para ECLS. – Garantizar el método de transporte – Distancia y tiempo de transporte a las instalaciones – Atención y monitoreo continuos – Actualizaciones sobre la hora estimada de llegada y el estado del paciente con las instalaciones receptoras en camino – Proporcionar un informe completo del paciente | – Dispositivos de comunicación. |
Selección y calificación de pacientes para soporte vital extracorpóreo
Las indicaciones para el recalentamiento con ECLS en casos de AH grave incluyen HCA o inestabilidad hemodinámica para prevenir una CA posterior.
Paro cardíaco hipotérmico
El soporte vital extracorpóreo está indicado en pacientes con HCA, temperaturas centrales <30 °C (86 °F) y probabilidad estimada de supervivencia ≥10 %, según la puntuación de predicción de resultados de hipotermia después de ECLS (HOPE) ( Figura 2 ).
La puntuación HOPE estima la probabilidad de supervivencia después del soporte ECLS para pacientes con CA por HA.
Una calculadora en línea de la puntuación HOPE está disponible en www.hypothermiascore.org.

No existe una contraindicación absoluta para el recalentamiento con ECLS en pacientes con CA hipotérmica cuya temperatura central sea <30 °C.
El recalentamiento con ECLS en pacientes con CA hipotérmica cuya temperatura central se encuentre entre 30 °C y 32 °C, o cuya probabilidad de supervivencia estimada por HOPE sea <10 %, puede considerarse excepcionalmente. CA, paro cardíaco; ECLS, soporte vital extracorpóreo; ECMO, oxigenación por membrana extracorpórea; ECPR, reanimación cardiopulmonar extracorpórea. Figura publicada con autorización ( ASAIO ).
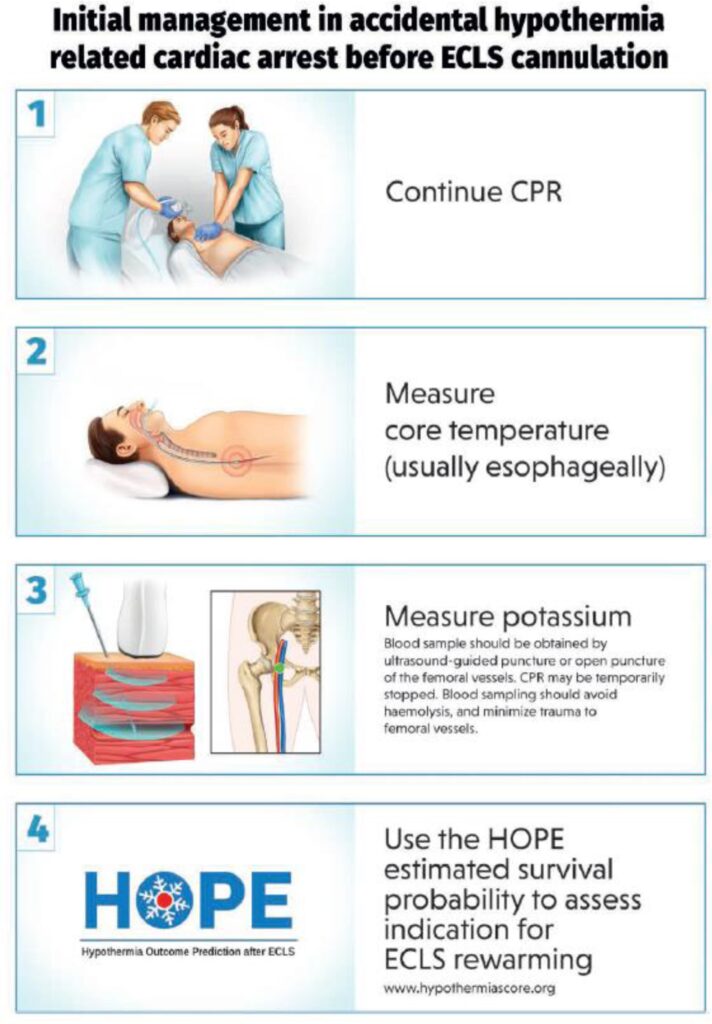
Si el paciente se considera candidato para ECLS, se debe continuar con RCP hasta que se establezca el ECLS. Se debe medir la temperatura central con una sonda esofágica ( Figura 3 ).
Tenga cuidado al obtener una medición de potasio de los vasos femorales, ya que un hematoma (relacionado con la coagulopatía) puede complicar la canulación de ECMO. Por lo tanto, la punción de los vasos femorales debe ser guiada por ultrasonido. La HCA no presenciada, la asistolia, los tiempos prolongados sin flujo y de bajo flujo, la edad ≥70 y el dióxido de carbono tidal final bajo (EtCO 2 ) no son contraindicaciones para el ECLS para la HCA ( Figura 2 ).
Existen diferencias significativas entre la CA hipotérmica y normotérmica. Los criterios de soporte vital con soporte extracorpóreo establecidos para pacientes normotérmicos no deben utilizarse para pacientes hipotérmicos.
Pacientes hipotérmicos con circulación espontánea preservada
Las indicaciones para el recalentamiento con ECLS en pacientes con hipotermia grave y circulación espontánea preservada no se han establecido con precisión, pero la hipotensión <90 mmHg o la presencia de una arritmia ventricular suelen determinar la presencia de inestabilidad hemodinámica al decidir si un paciente es apto para ECLS.
Las víctimas de HA con inestabilidad hemodinámica pueden beneficiarse del recalentamiento extracorpóreo en comparación con métodos menos invasivos.
En pacientes con cardiopatía isquémica (AC), la canulación y el recalentamiento del ECLS no deben retrasarse para la tomografía computarizada (TC). Si hay signos de trauma, considere el recalentamiento del ECLS con anticoagulación mínima o nula. Una vez lograda la circulación estable con ECMO venoarterial (VA), los pacientes con posible trauma pueden someterse a una TC para evaluar las lesiones.
En pacientes con circulación preservada y temperatura central inferior a 30 °C, la decisión de realizar una TC debe sopesarse cuidadosamente frente a los beneficios de la imagen y el posible riesgo de AC, especialmente en el grupo de pacientes hemodinámicamente inestables candidatos a ECLS.
Modo soporte vital extracorpóreo y consideraciones técnicas
La derivación cardiopulmonar (CPB) o la ECMO VA se pueden utilizar para el recalentamiento dependiendo de la disponibilidad inmediata. Sin embargo, la ECMO VA necesita menos recursos, es más pequeña, móvil, requiere menos heparina y es adecuada para el soporte cardiorrespiratorio prolongado en caso de complicaciones cardiopulmonares y puede tener resultados superiores.
Es razonable utilizar CPB si la ECMO no está disponible, especialmente en incidentes de multicausalidad con hipotermia grave. El tratamiento extracorpóreo de pacientes con hipotermia grave sirve no solo para lograr la normotermia sino también para estabilizar los sistemas cardiovascular y respiratorio y para compensar los trastornos metabólicos. El sistema preferido es la ECMO VA femoro-femoral con una cánula de perfusión distal.
La canulación vascular puede ser difícil debido a los efectos de la baja temperatura en los vasos y los tejidos circundantes. La configuración femorofemoral (arterial/venosa) se puede establecer rápidamente sin interrumpir la RCP y es la configuración preferida para establecer el acceso de emergencia en adultos, adolescentes y niños >20 kg. En niños pequeños y bebés, la mejor forma de canularlos es mediante una incisión quirúrgica en los vasos del cuello derecho.
Los operadores deben considerar el alto riesgo de sangrado causado por la coagulopatía asociada a la hipotermia y, cuando sea posible, deben elegir el método de canulación percutáneo menos invasivo. La canulación debe realizarse con guía ecográfica. Para mantener la seguridad en momentos clave, como la punción del vaso, la introducción de la guía y la cánula, es razonable interrumpir la RCP durante un breve periodo.
De lo contrario, las interrupciones en la RCP deben mantenerse al mínimo. Debido a las dificultades para obtener sangre para análisis de laboratorio en pacientes hipotérmicos, puede ser aconsejable recolectar sangre durante la canulación para determinar parámetros de laboratorio críticos.
La esterilidad estricta del campo operatorio durante la canulación es fundamental para prevenir infecciones del torrente sanguíneo. Las cánulas deben colocarse bajo control fluoroscópico o ecocardiografía transesofágica. La hipotermia aumenta la ecogenicidad de la sangre. En las imágenes cardíacas, la sangre normal en las aurículas o los ventrículos puede parecer coágulos.
La ventilación del ventrículo izquierdo rara vez es necesaria, ya que el corazón suele comenzar a eyectar tras el recalentamiento y la oxigenación. Sin embargo, se debe considerar la ventilación según los criterios habituales y la práctica del ECLS si persiste la distensión del ventrículo izquierdo (VI) o si sobreviene congestión auricular o pulmonar izquierda.
La canulación femoral bilateral se asocia con un menor riesgo de síndrome compartimental, hemorragia, necesidad de fasciotomía o reparación vascular durante el ECLS y una menor mortalidad hospitalaria en comparación con otras configuraciones.
Manejo del paciente y del circuito durante la soporte vital extracorpóreo
Se deben aplicar parches de desfibrilación en lugar de derivaciones de electrocardiograma (ECG), ya que el temblor reduce el artefacto electrocardiográfico. Los parches de desfibrilación permiten la detección y el tratamiento rápidos de ritmos desfibrilables.
Las arritmias ventriculares y la asistolia pueden ser refractarias hasta que el paciente se recaliente a más de 30 °C.
En una configuración VA femoro-femoral, el punto de mezcla intraaórtico entre el gasto cardíaco nativo oxigenado por los pulmones y el flujo sanguíneo ECMO a través de la cánula de retorno se mueve distalmente por la aorta a medida que mejora el gasto cardíaco nativo. La saturación de oxígeno y la presión parcial de oxígeno en la arteria radial derecha son casi iguales a la sangre que perfunde el cerebro. La oximetría de pulso (SpO 2 ) y la PaO 2 deben medirse en el brazo derecho.
En HCA, la saturación periférica de oxígeno (SpO 2 ) y la presión parcial de oxígeno en la sangre arterial (PaO 2 ) disminuyen a medida que mejora el gasto cardíaco nativo, lo que refleja el movimiento distal del punto de mezcla con más flujo sanguíneo parcialmente oxigenado por el pulmón lesionado.
La oxigenación diferencial puede ocurrir en una configuración VA femoro-femoral si la función pulmonar se ve afectada por aspiración o traumatismo. En tales condiciones, la parte superior del cuerpo recibe una cantidad significativamente reducida de oxígeno y existe el riesgo de isquemia cerebral. Si esto ocurre, la configuración debe cambiarse a venoarteriovenosa (VAV).
Para asegurar una perfusión cerebral adecuada, el objetivo de presión sistémica media debe estar entre 50 y 70 mmHg. Se debe utilizar la monitorización con espectroscopia de infrarrojo cercano (NIRS) para medir la oxigenación cerebral. La presión de perfusión cerebral debe mantenerse mediante reanimación con líquidos con cristaloides isotónicos calientes y vasopresores.
En las etapas iniciales del tratamiento, existe una gran necesidad de fluidoterapia. Los líquidos pueden administrarse a través del circuito ECLS en ausencia de un acceso vascular periférico adecuado.
Las víctimas supervivientes de avalanchas o inmersiones presentan un alto riesgo de sufrir complicaciones respiratorias, como neumonía por aspiración y traumatismo torácico pos-reanimación. Se debe utilizar ventilación pulmonar protectora ( Tabla 2 ). La prevención y el tratamiento de infecciones son los mismos que en otros pacientes con ECMO.
Tabla 2. – Parámetros del ventilador durante el recalentamiento del soporte vital extracorpóreo
Generalmente ≤6 ml/kg de peso corporal ideal Frecuencia 10–12/min
PEEP cualquier nivel (5–15 cm H2O )
Presión meseta <30 cm H2O
Presión de conducción (Δ P : presión meseta—PEEP <15 cm H2O )
FiO2 0,3–1,0 ( evitando hipoxia o hiperoxia)
PCO2 (alfa stat): 4,5–5,5 kpa (35–45 mm Hg )
Se debe utilizar anticoagulación para prevenir complicaciones trombóticas durante la ECLS. La ECMO VA puede manejarse de forma segura sin anticoagulación o con niveles bajos de anticoagulación durante un tiempo limitado si existe una coagulopatía profunda. Se debe monitorizar la anticoagulación.
- Administrar heparina no fraccionada o bivalirudina mediante infusión continua con un objetivo de tiempo de coagulación activado (ACT) de 150 a 180 segundos, una relación de tiempo de tromboplastina parcial activada (aPTT) de 1,5 a 2, PTT de 60 a 80 segundos (si se utilizan inhibidores directos de la trombina) o antiXa (si se utiliza heparina) de 0,2 a 0,3 UI/ml.
- Si existe un alto riesgo de sangrado, iniciar ECMO sin anticoagulante.
- Suspender la anticoagulación si hay sangrado excesivo.
- Adoptar un protocolo de anticoagulación basado en la evidencia actual.
- Definir prioridades en caso de sangrado que requiera un tratamiento menos invasivo.
El manejo de los gases en sangre debe seguir los protocolos institucionales (Tabla 3).
Las mediciones de gases en sangre arterial deben utilizar el procedimiento alfa STAT (no corregido por temperatura).
| Estadísticas alfa | pH Stat |
|---|---|
| Se llama así porque el estado de ionización de los grupos enzimáticos α-histidina-imidazol se mantiene constante. | Se llama así porque el pH se mantiene en 7,4 independientemente de la temperatura de la sangre. |
| Los resultados del análisis de gases en sangre no se corrigen según la temperatura corporal | Resultados del análisis de gases en sangre corregidos según la temperatura corporal |
| Objetivo = gases sanguíneos “normales” a 37 °C | Objetivo = temperatura sanguínea “normal” |
| Se tolera la hipocapnia y la alcalosis corregidas por la temperatura | Se tolera la hipercapnia y la acidosis no corregidas por la temperatura. |
| No se administra CO2 adicional al paciente | Se administró CO2 adicional al paciente |
| Mantiene la autorregulación cerebral | Desacopla la autorregulación cerebral |
| Evita posibles problemas de exceso de flujo sanguíneo cerebral como hipertensión intracraneal y aumento de microembolización. | El flujo sanguíneo cerebral aumenta independientemente de la demanda metabólica cerebral, lo que puede causar hipertensión intracraneal y aumento de la microembolización. |
| El pH alcalino mejora la protección cerebral durante el insulto isquémico | El dióxido de carbono provoca vasodilatación sistémica, lo que resulta en un enfriamiento más rápido y homogéneo. |
| Atrapamiento intracelular de intermediarios metabólicos y mantenimiento de la función proteica | Contrarresta el desplazamiento hacia la izquierda de la curva de disociación hemoglobina-oxígeno que ocurre con la hipotermia y la alcalemia inducida por hipotermia aumenta la descarga de hemoglobina a los tejidos y puede aumentar el suministro de oxígeno, lo que puede optimizar la función miocárdica. |
| Estrategia preferida en caso de hipotermia accidental | Estrategia no preferida en caso de hipotermia accidental |
La tasa de recalentamiento objetivo es de hasta 5 °C/hora hasta una temperatura central de 30 °C o el retorno a la circulación espontánea (ROSC), lo que ocurra primero. El recalentamiento posterior debe seguir las pautas para la hipotermia terapéutica.
La temperatura de salida arterial del oxigenador debe monitorearse continuamente. No se debe exceder un gradiente de temperatura entre la entrada venosa y la salida arterial de ≤4 °C. La temperatura establecida del calentador de agua no debe superar en 10 °C la temperatura de entrada venosa, hasta un máximo de 42 °C. El incumplimiento de estas reglas puede causar complicaciones neurológicas graves y hemólisis de las células sanguíneas. Se debe monitorear la temperatura central.
Debido al calentamiento de la aorta descendente y al rápido aumento de la temperatura esofágica, la temperatura medida puede no reflejar la temperatura central real. La temperatura central también debe monitorearse en una ubicación adicional.
Se debe considerar la interrupción del ECLS si no se logra RCE a 32 °C – 35 °C (89,6 °F – 95 °F). La decisión de suspender el tratamiento también debe basarse en información clínica adicional, como hemorragia incontrolable, nueva información sobre la causa de la AC o signos de lesión cerebral anóxica grave.
Puede ser necesaria la sedación y la analgesia para evitar el despertar, el movimiento o la tos incontrolados. La sedación puede reducirse o suspenderse cuando se alcance la normotermia con función hemodinámica y pulmonar estables.
Complicaciones
Las complicaciones durante la soporte vital extracorpóreo ECLS son frecuentes, lo que disminuye la probabilidad de supervivencia. Las complicaciones durante la ECLS para recalentamiento son similares a otras indicaciones para ECMO VA e incluyen problemas con el acceso, la circulación sistémica y el circuito.
En la AC prolongada, existe la posibilidad de lesión torácica con la consiguiente insuficiencia respiratoria que requiere ventilación mecánica prolongada y soporte de membrana extracorpórea.
Debido a los trastornos metabólicos y la fisiopatología de la hipotermia grave, existe la posibilidad de insuficiencia renal que requiera el uso de técnicas de reemplazo renal.
Destete del soporte vital extracorpóreo
La insuficiencia cardíaca es un hallazgo frecuente, que se presenta como aturdimiento ventricular izquierdo, derecho o combinado.
Se pueden añadir inotrópicos. Se debe utilizar una ecocardiografía seriada (función del VI/contracción concéntrica) para evaluar el gasto cardíaco nativo, la función ventricular izquierda y la apertura de la válvula aórtica, así como para descartar patologías valvulares mayores.
Se puede intentar la retirada gradual del soporte circulatorio mecánico una vez que la temperatura central sea >35 °C (95 °F). Si se evidencia una mejoría de la fracción de eyección del ventrículo izquierdo mediante ecocardiografía y una hemodinámica estable, el flujo sanguíneo del ECLS puede reducirse al 50 % y posteriormente al 25 % del gasto cardíaco adecuado. Cuando el soporte del ECLS es inferior al 30 % del total, la función cardiorrespiratoria nativa puede ser adecuada para permitir la suspensión del ECLS.
La retirada gradual del soporte circulatorio mecánico tiene éxito en el 30-70 % de los pacientes.
Pueden ser necesarios vasopresores e inotrópicos para contrarrestar la vasoplejía y el aturdimiento cardíaco.
La selección y dosificación de inotrópicos, vasopresores e inodilatadores (medicamentos con efectos tanto inotrópicos como vasodilatadores) debe ajustarse al perfil hemodinámico. Existe poca evidencia que respalde prácticas específicas en este ámbito y una considerable variabilidad entre instituciones, incluyendo aquellas que evitan por completo el apoyo inotrópico para el reposo cardíaco
Sin embargo, en pacientes con CA tratados con ECPR, el uso de levosimendan en la unidad de cuidados intensivos (UCI) se asoció con una mortalidad hospitalaria significativamente menor, tasas más altas de destete de la ECMO y tasas sustancialmente más bajas de lesión cerebral anóxica.
El destete puede retrasarse debido a la insuficiencia respiratoria persistente.
En pacientes hemodinámicamente estables con insuficiencia respiratoria persistente, la ECMO VA puede convertirse en ECMO venovenosa (VV) para soporte respiratorio. La estrategia de destete debe adaptarse a las necesidades de cada paciente. El tratamiento extracorpóreo de pacientes con hipotermia grave implica no solo el recalentamiento extracorpóreo, sino también la estabilización hemodinámica y metabólica, y la corrección de los trastornos respiratorios. Puede ser útil obtener información complementaria sobre las circunstancias en el campo, los diagnósticos primarios o secundarios y la evolución clínica del proceso de reanimación.
Se debe implementar un paquete de cuidados posteriores a la reanimación, que incluya oxigenación y ventilación adecuadas, reperfusión coronaria, monitoreo y manejo hemodinámico, control de convulsiones, regulación de la temperatura, manejo general de cuidados intensivos, predicción de resultados y rehabilitación.
La predicción de resultados neurológicos se debe realizar en consulta con un neurólogo una vez que se suspende la sedación.
Resultados soporte vital extracorpóreo
Parada cardíaca hipotérmico
Los pacientes con HCA extrahospitalaria tuvieron mejor supervivencia con resultados neurológicos más favorables que los pacientes con CA normotérmica.
Otro estudio encontró mayor supervivencia (53,8% frente a 22,5%) en pacientes tratados con ECLS por paro circulatorio hipotérmico comparado con CA normotérmica.
La tasa de supervivencia varía del 37% al 85% y se puede esperar un buen resultado cerebral en el 80-90% de los supervivientes.
Se han demostrado buenos resultados en pacientes a pesar de la aparición de factores que son contraindicaciones para la implementación de ECLS en normotermia. La HCA no presenciada, la asistolia, los tiempos largos sin flujo y de bajo flujo, la edad ≥70 y el EtCO2 bajo
no son contraindicaciones para el ECLS por HCA.
En el estudio de Podsiadło et al ., en el grupo de pacientes con ACV no presenciada, se observó una tasa de supervivencia del 27%.
La mayoría de los supervivientes (83%) presentan un buen pronóstico neurológico. En el 48% de los supervivientes, la asistolia fue el ritmo principal de ACV.
A pesar de la larga duración del paro cardíaco, el papel protector de la hipotermia ha mostrado buenos resultados en el tratamiento extracorpóreo de pacientes con HCA. Saczkowski et al . muestran que el tiempo medio hasta el paro cardíaco en pacientes
Con un buen resultado del tratamiento, el tiempo de recuperación es de 116 minutos. De igual manera, Pasquier et al . muestran un tiempo de 106 minutos en este grupo de pacientes. En la literatura, existen descripciones de pacientes con periodos muy prolongados de HCA, de más de 5 horas de duración, que completaron con éxito la recuperación tras el uso de tratamiento extracorpóreo.
A pesar de los peores resultados asociados con la edad, los pacientes mayores con AHC pueden sobrevivir con buen pronóstico. Tener más de 70 años no debería ser un factor descalificador para el tratamiento extracorpóreo de pacientes con hipotermia grave.
Hacer un seguimiento de pacientes hipotérmicos
El Registro Internacional de Hipotermia recopila datos de pacientes hipotérmicos en todo el mundo y evalúa sus resultados.
Los datos de pacientes con PC hipotérmica, incluyendo datos extrahospitalarios e intrahospitalarios, el mecanismo de la PC hipotérmica, el estado actual (temperatura central, ECG, duración de la RCP y potasio sérico), se utilizan para calcular la probabilidad de supervivencia mediante la escala HOPE.
Los datos también deben recopilarse tras el alta hospitalaria. Estos datos pueden ser útiles para reevaluar la probabilidad de supervivencia en futuros pacientes.
Infografía Guía ELSO de ECMO para la hipotermia accidental

Artículo original
ELSO 2025 Narrative Guideline on the Use of ECMO for Accidental Hypothermia
Autores
Enfría, Evelien; Swol, Justyna; Wanscher, Michael; Brugger, Hermann; Pasquier, Mathieu; McIntosh, Scott; Musi, Martín; Oshiro, Kazue; Gordon, Les; Walpoth, Beat; Hoffman, Jordania RH; Follis, Fabrizio; Zafren, Ken; Paal, Peter; Giraud, Rafael; Podsiadlo, Pawel; Martucci, Gennaro; Darocha, Tomasz.
Revista ASAIO 71(11):p 865-874, noviembre de 2025. | DOI: 10.1097/MAT.0000000000002557









Deja un comentario