La Sociedad Médica de Áreas Silvestres (WMS) convocó a un panel de expertos para desarrollar directrices basadas en la evidencia para el manejo del dolor en entornos naturales.
Las recomendaciones se clasifican según la calidad de la evidencia que las respalda, según los criterios establecidos por el Colegio Americano de Médicos Torácicos.
Esta es una actualización de la versión de 2014 de las «Guías Prácticas de la WMS para el Tratamiento del Dolor Agudo en Entornos naturales y remtos», publicadas en Wilderness & Environmental Medicine 2014.
Vídeo resumen
Resumen en vídeo de las directrices basadas en la evidencia para el manejo del dolor en entornos naturales.
Introducción

El tratamiento del dolor es importante en el manejo de enfermedades y lesiones en cualquier contexto. Más allá de las consideraciones éticas al final de la vida y manejo del sufrimiento, el manejo eficaz del dolor agudo en entornos naturales puede facilitar la evaluación, el empaquetamiento y el transporte de pacientes cuyo manejo, de otro modo, sería difícil o imposible sin el control del dolor.
El manejo del dolor agudo es un desafío multifactorial que puede incluir la estabilización física de una lesión o herida musculoesquelética, el manejo médico de las respuestas dolorosas de mediación periférica y central, y el manejo del distrés psicológico y la ansiedad. Cualquier tratamiento del dolor conlleva riesgos y beneficios que pueden verse amplificados cuando se utilizan en un entorno natural.
El acceso limitado al paciente, la dificultad de reevaluación durante el traslado, la necesidad de proteger al paciente de las agresiones ambientales, la falta de equipos de monitorización y los recursos limitados para responder a los efectos adversos de los tratamientos pueden amplificar los riesgos. Por consiguiente, el tratamiento del dolor en un entorno natural requiere un enfoque reflexivo y progresivo que minimice el daño, a la vez que atiende las necesidades del paciente y del equipo médico.
Los entornos naturales se definen como: entornos silvestres, remotos o con recursos muy limitados, donde no se dispone de acceso a recursos hospitalarios o de servicios médicos de emergencia (SEM), y la evacuación puede ser difícil o prolongada. Incluimos entornos silvestres y de expedición, así como otros viajes a regiones donde los integrantes deben ser autosuficientes en su atención médica. Excluimos de esta guía el manejo del dolor en el ámbito militar, donde los recursos y la disponibilidad de evacuación son generalmente mayores y para los cuales ya existen guías.
También excluimos el manejo del dolor agudo en viajes espaciales, donde la fisiología y las limitaciones de recursos son verdaderamente únicas. Se ha elegido el término «entorno natural» en lugar de «remoto» en esta guía, ya que describe mejor un entorno con recursos limitados y desafíos ambientales. Cuando el terreno, el clima o la altitud suponen un desafío para la atención médica, los recursos sanitarios no necesitan ser geográficamente remotos para ser funcionalmente de difícil acceso.
Los detalles legales de la adquisición, almacenamiento y la administración de sustancias farmacológicas quedan fuera del alcance de esta guía. La variación entre países y jurisdicciones, e incluso dentro de ellos, es excesiva para facilitar recomendaciones específicas para todos los entornos. Además, no limitamos las recomendaciones de esta guía a una clase, certificación o nivel de capacitación específico de personal de respuesta médica.
Tanto los usuarios deportivos en zonas rurales como el personal médico de respuesta capacitado deben utilizar su criterio para determinar qué modalidades de tratamiento se ajustan a su capacitación y son adecuadas para su entorno de tratamiento y los recursos disponibles. En cada una de las secciones siguientes, presentamos la mejor evidencia disponible identificada por el panel en cuanto a la seguridad, la eficacia y las consideraciones específicas para cada caso de las modalidades de tratamiento del dolor disponibles.
Método del estudio
Se convocó un panel de expertos durante la reunión anual de invierno de 2013 de la Wilderness Medical Society (WMS) en Park City, Utah, y se publicó una guía original en Wilderness and Environmental Medicine en 2014.
Posteriormente, se convocó un panel de expertos en 2019, y se realizó una revisión parcial inédita de la guía, integrando fuentes bibliográficas actualizadas. Para completar esta revisión bibliográfica actualizada, se convocó un panel en julio de 2022, cuya participación se basó en la experiencia clínica, de investigación o de campo relevante de cada participante.
El panel incluyó representantes de medicina de urgencias, anestesiólogos, cirugía y servicios médicos de urgencias prehospitalarios (SEM).Se realizó una revisión de artículos de investigación relevantes mediante una búsqueda de palabras clave en las bases de datos MEDLINE y PubMed Central a través de la interfaz de búsqueda de PubMed, además de consultas en SCOPUS y Google Académico utilizando palabras clave específicas para cada área temática, con filtros aplicados para eliminar fuentes en idiomas distintos del inglés. Las búsquedas se completaron entre junio y agosto de 2022.
Las palabras clave buscadas fueron generadas por los autores de las secciones. Los autores de las secciones examinaron los resúmenes para determinar su relevancia en entornos austeros, su relevancia fundamental para la comprensión y el tratamiento del dolor, o la farmacología y la farmacodinamia de los medicamentos analizados. Se identificaron fuentes adicionales mediante la revisión de citas de fuentes identificadas y artículos de revisión.
Cuando no se disponía de evidencia directamente pertinente para entornos austeros, se incluyó la mejor evidencia disponible de fuentes bibliográficas sobre servicios médicos de emergencia (SME), medicina táctica, medicina de desastres, medicina de emergencia y salud global. Las modalidades de control del dolor se incluyeron según el consenso de expertos, y cualquier modalidad sugerida por cualquier miembro del panel se sometió a una búsqueda bibliográfica para encontrar evidencia y aplicaciones relevantes.
Se excluyeron artículos por falta de relevancia, según lo determinado por la revisión de expertos. También se seleccionaron para su inclusión artículos de revisión relevantes adicionales obtenidos como antecedente, así como guías relevantes para el manejo del dolor agudo y las lesiones traumáticas.
Las recomendaciones fueron elaboradas por los autores de las secciones y revisadas mediante consenso. Cuando la evidencia relevante para entornos naturales fue limitada o de baja calidad, las recomendaciones se formularon por consenso del grupo médico, basándose en la experiencia clínica de los miembros del panel y la bibliografía pertinente de medicina hospitalaria y prehospitalaria. Las recomendaciones se calificaron según los criterios desarrollados por el Colegio Americano de Médicos Torácicos.
Las recomendaciones finales incluidas fueron aprobadas por unanimidad por todos los miembros del panel.
Los términos utilizados en la guía para hablar sobre el dolor, como “dolor”, “nocicepción” y “sensibilización”, se utilizan de manera coherente con los términos y definiciones de la Asociación Internacional para el Estudio del Dolor.
Enfoque general para el manejo del dolor en un entorno natural
Las lesiones musculoesqueléticas, como distensiones, esguinces, luxaciones y fracturas, son la causa más común de dolor que se trata en entornos naturales. Otras circunstancias que pueden requerir tratamiento del dolor incluyen enfermedades agudas y lesiones ambientales como lesiones por frío, mordeduras, picaduras y quemaduras.
En todos los casos, el manejo del dolor es una consideración secundaria al manejo de las amenazas inmediatas para la vida, incluyendo el compromiso de la vía aérea, la respiración o la circulación, y secundaria a la seguridad en el lugar de los hechos, tanto para el paciente como para el personal médico. Tras abordar la seguridad en el lugar de los hechos y realizar una evaluación primaria, se debe realizar una evaluación secundaria para evaluar la causa y la gravedad del dolor.
Las lesiones tisulares traumáticas, el calor, el frío y la isquemia pueden causar dolor por diferentes mecanismos, y comprender el mecanismo de la lesión o enfermedad facilita el tratamiento adecuado. En un paciente alerta, la descripción del mecanismo, la localización, la calidad y la intensidad del dolor pueden orientar el tratamiento. En un paciente que no coopera o no responde, la evaluación del entorno y la realización de una evaluación secundaria exhaustiva pueden identificar lesiones traumáticas y ambientales basándose en la deformidad y la apariencia del tejido.
El control del dolor no debe negarse por temor a enmascarar lesiones o limitar la calidad de la exploración, y los mitos que lo contradicen han sido desmentidos mediante evidencia de calidad y recomendaciones de expertos.
Si es posible, antes de tratar el dolor, los profesionales sanitarios deben evaluar la intensidad del dolor para poder evaluar la respuesta al mismo. Se debe utilizar una escala de valoración numérica (p. ej., la Escala de Valoración Numérica [NRS-11] o la Escala Visual Analógica [EVA]) o la descripción subjetiva del paciente de la intensidad del dolor para evaluar la respuesta a los tratamientos.
Sin embargo, los protocolos no deben imponer el uso obligatorio de medicamentos u otras intervenciones en respuesta a puntuaciones específicas, ya que se ha demostrado que un enfoque rígido que exige el tratamiento en respuesta a un umbral específico aumenta los eventos adversos relacionados con la medicación.
Salvo algunas intervenciones psicosociales, todas las modalidades de tratamiento del dolor que se analizarán a continuación conllevan beneficios y riesgos para el paciente. En general, los fármacos de acción central (p. ej., opioides, benzodiazepinas) conllevan un mayor riesgo que los fármacos de acción periférica (no esteroides, anestésicos locales) debido a su potencial para afectar la hemodinámica y la respiración.
Las vías de administración (parenteral [PT] /intranasal [IN]/intramuscular [IM]/intravenosa [IV]/intraósea [IO]) conllevan un mayor riesgo de efectos adversos que las vías enteral o tópica debido a su absorción acelerada y al menor tiempo hasta alcanzar la concentración sérica máxima. Cabe destacar que la relación entre el riesgo y el beneficio no siempre es directa, y algunas intervenciones de bajo riesgo, como el apoyo psicológico o la inmovilización de la lesión, pueden ser considerablemente eficaces en el tratamiento del dolor.
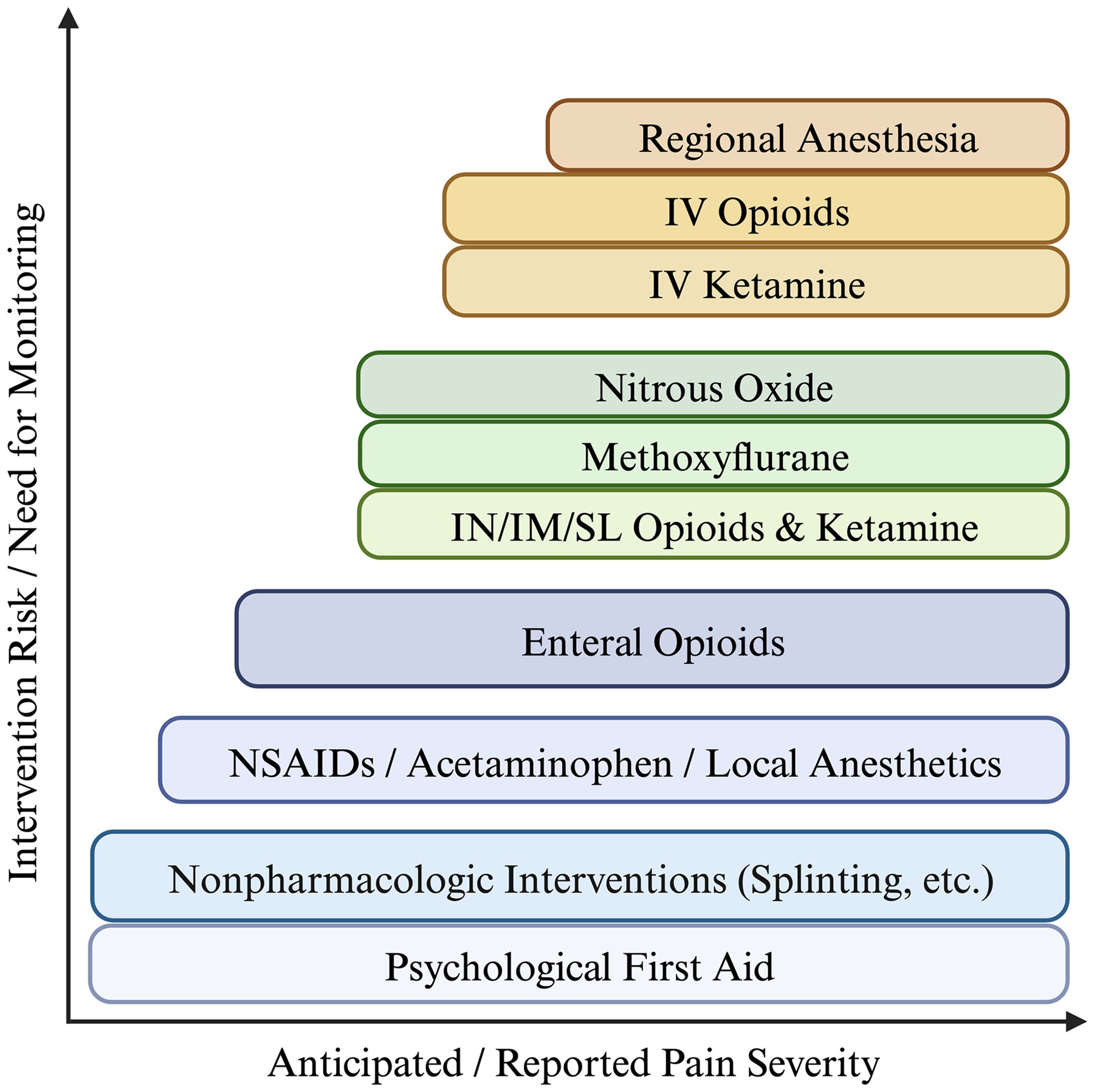
Si bien las directrices anteriores de WMS recomendaban un enfoque gradual y progresivo para el control del dolor, actualizamos este enfoque para considerar situaciones en las que el profesional clínico reconoce una causa inherentemente grave de dolor e inicia inmediatamente medidas terapéuticas más agresivas.<sup> </sup> En consecuencia, recomendamos un enfoque para el tratamiento del dolor que seleccione y aplique simultáneamente las modalidades terapéuticas según la experiencia del profesional clínico, la causa del dolor y la evaluación de la gravedad del dolor notificada y prevista. Siempre que sea posible, seguimos recomendando el uso de intervenciones de menor riesgo antes o en conjunto con las de mayor riesgo. ofrece un esquema conceptual de cómo se podrían seleccionar las diferentes modalidades en función de la gravedad del dolor y los recursos disponibles.
Tras la aplicación de un tratamiento determinado, se debe reevaluar el nivel de dolor del paciente y el profesional sanitario debe determinar si el control del dolor es adecuado para satisfacer las necesidades del paciente y del profesional o equipo sanitario. Dado que las diferentes modalidades de control del dolor son apropiadas para los distintos mecanismos de lesión y enfermedad, no puede existir un enfoque prescriptivo claro ni una guía lineal para el tratamiento del dolor.
En algunos pacientes, la ansiedad y el malestar psicológico pueden amplificar significativamente la respuesta a una lesión leve, mientras que en otros, una lesión ortopédica aislada puede ser susceptible a una intervención específica (p. ej., bloqueo de hematomas), lo cual es inapropiado en otros casos. La experiencia y el buen juicio, junto con la reevaluación frecuente del paciente y su entorno, son fundamentales.
Las respuestas médicas en un entorno natural son inherentemente limitadas, por lo que es necesario evaluar y seleccionar tratamientos para el dolor que minimicen el peso y el volumen del medicamento. Un medicamento ideal para entornos austeros es compacto; ligero; resistente al aplastamiento, la abrasión, el calor y el frío; no sedante; con un amplio margen terapéutico; compatible con múltiples vías de administración; y sin potencial de abuso ni dependencia.
Dado que no existe tal medicamento, los profesionales sanitarios deben sopesar las ventajas y desventajas de cada medicamento que se ofrece, considerando las limitaciones previas.
Una encuesta a proveedores en la conferencia de verano de WMS en 2016 demostró que entre los encuestados médicos en ejercicio, el 90 % llevaba medicamentos antiinflamatorios no esteroideos (AINE) orales (VO), el 81 % llevaba acetaminofén (APAP) y el 47 % llevaba opioides VO al seleccionar medicamentos para caminatas organizadas.
Es probable que estos medicamentos, además de la capacitación en el manejo no farmacológico del dolor, sean suficientes en muchos entornos, ya que las lesiones ortopédicas menores y las heridas de tejidos blandos comprenden la mayoría de los casos. Sin embargo, en el manejo del dolor agudo severo, estos medicamentos pueden ser inadecuados.
En las siguientes secciones, profundizamos en las modalidades de control del dolor. En cada sección, analizamos los riesgos y beneficios de estas intervenciones, así como las aplicaciones para las que son más adecuadas. Además, abordamos consideraciones terapéuticas, como la necesidad de monitorizar los efectos adversos.
Algunos de estos tratamientos son avanzados y requieren experiencia que solo puede desarrollarse en entornos clínicos con un alto volumen de pacientes, como hospitales y servicios de emergencias médicas (SME). Estos tratamientos brindan oportunidades para que los equipos de rescate organizados y los profesionales médicos especializados perfeccionen su tratamiento del dolor, pero no son necesarios per se y, en algunos entornos, pueden resultar inapropiados o excesivos.
Recomendación: Recomendamos que los proveedores manejen el dolor a un nivel que proporcione un alivio adecuado, satisfaga las necesidades del equipo tratante y reconozca las limitaciones impuestas al equipo por el entorno natural
(recomendación fuerte, evidencia de calidad moderada).
Recomendación: Recomendamos que, cuando sea apropiado para el entorno clínico, los proveedores evalúen la respuesta del paciente a los tratamientos del dolor de bajo riesgo antes de progresar a modalidades de tratamiento o vías de administración de mayor riesgo para minimizar el daño en un entorno natural
(recomendación fuerte, evidencia de baja calidad).
Recomendación: Recomendamos que, cuando sea apropiado para el entorno clínico, los proveedores puedan iniciar múltiples tratamientos simultáneos para controlar el dolor de mayor gravedad informada o anticipada
(recomendación fuerte, evidencia de baja calidad).
Manejo no farmacológico del dolor en el medio natural
Intervenciones psicosociales
La experiencia del dolor es producto de señales nerviosas nociceptivas del sistema nervioso periférico, las cuales son interpretadas y dotadas de valencia emocional en el sistema nervioso central. En la práctica, esto significa que el estado psicológico del paciente puede afectar su experiencia del dolor.
Estudios de laboratorio han demostrado que las expresiones empáticas, el tacto cariñoso y la presencia de una pareja percibida como cariñosa pueden modular la experiencia del dolor, reducir las puntuaciones de dolor y afectar la respuesta autonómica al dolor.
La ansiedad, una función de detección de amenazas mediada por la amígdala, también es un potente mediador del dolor. Las situaciones de alta ansiedad inducidas en el laboratorio se asocian con puntuaciones de dolor más altas para un estímulo doloroso determinado. Además, una mayor intensidad del dolor agudo en urgencias se ha asociado con estados de ansiedad elevados, y el dolor posoperatorio se ha correlacionado con los niveles de ansiedad preoperatoria.
De hecho, se ha demostrado que las intervenciones conductuales perioperatorias reducen el dolor posoperatorio y la discapacidad relacionada con el dolor. La atención también puede manipularse para tratar el dolor; la distracción de un estímulo nocivo se asocia con puntuaciones de dolor agudo más bajas, mientras que la atención centrada en la fuente se asocia con puntuaciones de dolor más altas.
Dado que la empatía, el cuidado y la distracción pueden mitigar el dolor, y a la inversa, la ansiedad coincidente puede aumentarlo, las intervenciones psicosociales son potencialmente útiles en el tratamiento del dolor. Además, son adecuadas para un contexto austero, ya que son livianas, duraderas, portátiles y gratuitas.
La literatura más sólida sobre la reacción aguda al estrés y su mitigación proviene del trabajo en torno al trastorno de estrés postraumático (TEPT) derivado del combate. Las modalidades de tratamiento dirigidas a las reacciones al estrés en sobrevivientes de trauma se han codificado en un conjunto de herramientas conocido colectivamente como primeros auxilios psicológicos (PAP).
Los PAP, si bien se desarrollaron para tratar a sobrevivientes de combate, se han dirigido más recientemente a personal de respuesta en áreas silvestres y miembros de expediciones, y se han integrado en textos y planes de estudio médicos especializados en áreas silvestres.
El alcance completo de la PFA queda fuera del alcance de esta guía. Sin embargo, sus componentes principales proporcionan un marco y un vocabulario compartido para las intervenciones psicosociales que probablemente contribuyan al tratamiento del dolor mediante la mitigación de estados emocionales negativos, la limitación de la respuesta al estrés y la facilitación de conductas adaptativas.
Los autores han adaptado estos componentes en una regla mnemotécnica útil para la aplicación de la PFA en entornos naturales. (Tabla 1)
Tabla 1. El cuadro mnemotécnico ABCDE para el tratamiento psicosocial del dolor: Cuadro sugerido para la aplicación en el entorno natural de los primeros auxilios psicológicos para reducir el dolor agudo.
| A | Atención y Reconocimiento | Proporcionar al paciente una persona atenta que se identifique como responsable de su comodidad y que reconozca su angustia. |
| B | Respiración | Fomente una respiración profunda con control, limitando la respiración rápida y superficial o hiperventilación. |
| C | Control y cambio cognitivo | Proporcionar al paciente un rol que le permita un elemento de control sobre su situación y que aleje su mentalidad del catastrofismo. |
| D | Disminuir la nocicepción, Distraer, Difundir | Utilice otras intervenciones farmacológicas y no farmacológicas para tratar las señales nociceptivas. Distraiga al paciente de la fuente del dolor. Disipe la tensión mediante la empatía y el humor. |
| E | Explicaciones y expectativas | Proporcionar al paciente una estrategia de qué esperar en el futuro inmediato, como un rescate técnico o el transporte en vehículo o helicóptero. Explicar los procedimientos a realizar, el personal involucrado, los plazos previstos, etc. |
Recomendación: Recomendamos que los proveedores se capaciten y apliquen técnicas de primeros auxilios psicológicos relevantes para el tratamiento del dolor en entornos naturales
(recomendación fuerte, evidencia de baja calidad).
Entablillado, vendaje, inmovilización, crioterapia
El tratamiento de las lesiones musculoesqueléticas agudas ha implicado tradicionalmente variaciones del protocolo de tratamiento de «protección, reposo relativo, hielo, compresión y elevación» (PRICE). La evidencia es limitada. Sin embargo, el PRICE sigue siendo de uso generalizado, basándose en evidencia de calidad moderada y la opinión de expertos.

La base fisiológica que subyace a este enfoque es reducir la formación de edema. El edema extenso puede ser doloroso y perjudicial para la movilización y la curación del tejido.
Actualmente, el protocolo PRICE se considera el mejor régimen de tratamiento inicial para la sospecha de lesiones de tejidos blandos y fracturas.
Se ha propuesto una estrategia alternativa llamada protocolo de «movimiento, ejercicio, analgésicos y tratamiento/terapia» (MEAT) para el manejo de lesiones aisladas de ligamentos y tendones cuando se han descartado fracturas.
El protocolo MEAT abarca la inflamación, ya que el proceso inflamatorio promueve la curación y un retorno más rápido a la función normal. Un ensayo aleatorizado mostró que el ejercicio terapéutico temprano resultó en un retorno más rápido a la función normal en comparación con la terapia PRICE.
Si se sospecha fuertemente una lesión aislada de ligamentos o tendones y la fractura es poco probable, se puede sustituir por la terapia MEAT. Sin embargo, en un entorno austero, los proveedores pueden no poder diferenciar entre una fractura aguda o una lesión aislada de tejidos blandos y, por lo tanto, PRICE sigue siendo la terapia recomendada para la mayoría de las lesiones musculoesqueléticas agudas.
Se recomiendan las siguientes estrategias de tratamiento para obtener resultados óptimos al utilizar el protocolo PRICE:
- Protección contra lesiones adicionales y provisión de estabilidad adicional con vendajes, aparatos ortopédicos y/o férulas.
- El reposo relativo reducirá la inflamación y el dolor. Si es necesario evacuar, los pacientes pueden deambular.
- La aplicación de hielo o nieve, cuando esté disponible, disminuirá la temperatura de la piel por debajo de 15 °C, que es la temperatura a la que se inhibe la conducción nerviosa y disminuye el dolor. Una temperatura tisular más baja también reduce la formación de edema.
El enfriamiento debe realizarse con ciclos de 10 min de enfriamiento seguidos de 10 min de recalentamiento pasivo, siempre que sea práctico, durante las primeras 24 a 48 h posteriores a la lesión.
Este programa puede no ser logísticamente factible durante una evacuación. Los tejidos no deben enfriarse a un grado que pueda resultar en congelación o hipotermia.
Cuando no se dispone de hielo o nieve, se puede sustituir la terapia de enfriamiento por agua fría. La evidencia de la crioterapia es limitada, por lo que los riesgos de exponer la extremidad y al paciente a una posible congelación e hipotermia deben sopesarse frente a los modestos beneficios de la crioterapia. - Se puede usar compresión con una venda elástica o medias de compresión para reducir la hinchazón. Existe cierta evidencia que respalda esta práctica, aunque solo se han publicado unos pocos ensayos y los resultados son mixtos.
La compresión debe ajustarse a la forma del cuerpo, permitiendo al mismo tiempo una adecuada expansión muscular y un flujo sanguíneo adecuado. Se debe revisar regularmente el llenado capilar, la sensibilidad y el movimiento de las extremidades distales para detectar una compresión excesiva. - La elevación del área lesionada por encima del nivel del corazón reducirá la posible hinchazón.
Recomendación: Recomendamos utilizar los elementos aplicables del protocolo de tratamiento PRICE para lesiones musculoesqueléticas agudas como tratamiento de primera línea para el dolor en entornos austeros. En las lesiones en las que se considera improbable una fractura, se debe utilizar el protocolo de tratamiento MEAT (recomendación fuerte, evidencia de baja calidad).
Acetaminofén, antiinflamatorios y AINE
Acetaminofén (Paracetamol)
El acetaminofén (APAP), también conocido como paracetamol, es un analgésico y antipirético ampliamente utilizado. Actúa inhibiendo las vías de la ciclooxigenasa (COX) en el SNC, vías enzimáticas necesarias para la producción de prostaglandinas y prostaciclinas.
Tanto los efectos analgésicos como los antipiréticos del APAP se atribuyen a una reducción en la producción de prostaglandinas.
Investigaciones más recientes sugieren que el APAP también podría actuar como modulador del sistema cannabinoide.
Las acciones analgésicas y antipiréticas del APAP parecen limitarse al SNC, ya que no se ha demostrado que el medicamento actúe sobre las vías periféricas de la COX. Por esta razón, el APAP es ineficaz como antiinflamatorio.
El efecto secundario más común de la administración de APAP, aunque poco frecuente, es el malestar gastrointestinal.
Los efectos graves más comunes de la ingestión de APAP se observan con hepatotoxicidad por sobredosis significativa. El APAP se ha asociado con daño hepatocelular y muerte. Esto suele observarse en dosis altas, típicamente una administración única >4 g/día en adultos sanos, o en el uso crónico de dosis altas (aunque la toxicidad por una administración única <150 mg/kg para adultos o 200 mg/kg para niños es poco frecuente). Se debe tener precaución en alcohólicos crónicos y otros pacientes con disfunción hepática, donde la dosis diaria máxima segura de APAP puede desconocerse.
El APAP tiene la ventaja de ser ligero y compacto. Está disponible en formulaciones orales (comprimidos, cápsulas, jarabe y suspensión o solución), como supositorio rectal (PR) y como infusión intravenosa. Diversos estudios han evaluado la eficacia del APAP intravenoso frente a las administraciones orales y rectales (PR) y han encontrado un equilibrio clínico entre todas las formulaciones. La actividad analgésica de todas las formulaciones de APAP disminuye a las 6 h.
La administración oral de APAP suele ser la vía preferida en la mayoría de los entornos si el paciente puede tragar. La vía intravenosa puede utilizarse con buenos resultados, pero no se ha demostrado que esta sea una ventaja sobre otras. Si el paciente no puede tomar medicamentos por vía oral, la administración por vía oral probablemente sea más rápida, sencilla e igualmente eficaz. No hay evidencia que sugiera efectos teratogénicos por el uso de APAP durante el embarazo.
Recomendación: Recomendamos que la APAP, en cualquier formulación o vía de administración, se limite a una dosis diaria máxima de 60 mg/kg o 4gr en cuatro dosis divididas
(recomendación fuerte, evidencia de calidad moderada)
Recomendación: Recomendamos que, en un entorno natural, la APAP se administre por vía oral, si es posible. Si un paciente no tolera los medicamentos orales, recomendamos la administración rectal de APAP como segunda opción, con supositorio (preferible) o comprimidos orales por vía rectal (segunda opción)
(recomendación fuerte, evidencia de calidad moderada).
Antiinflamatorios no esteroides
Los fármacos antiinflamatorios no esteroideos (AINE) son una clase de medicamentos que actúan inhibiendo la COX para producir efectos antiinflamatorios, así como antipiréticos y analgésicos.
Se clasifican además en salicilatos (p. ej., aspirina), ácidos propiónicos (p. ej., naproxeno, ibuprofeno), ácidos acéticos (p. ej., diclofenaco, indometacina), ácidos enólicos (p. ej., meloxicam) e inhibidores selectivos de la COX-2 (p. ej., celecoxib). A excepción de los inhibidores selectivos de la COX-2, los AINE son inhibidores no selectivos de ambas enzimas COX: COX-1 y COX-2. La expresión de COX-1 está involucrada en la función renal, la agregación plaquetaria y el mantenimiento del revestimiento gastrointestinal (GI). La expresión de COX-2 generalmente es inactiva hasta que se induce durante una respuesta inflamatoria.
Se ha demostrado que los AINE son agentes analgésicos eficaces que evitan o reducen la necesidad de medicamentos opiáceos.
Los AINE tienen numerosos efectos adversos potenciales, principalmente relacionados con su inhibición no selectiva de la actividad de la COX-1. Si bien se ha demostrado que el uso a corto plazo de AINE de venta libre en dosis adecuadas es seguro y bien tolerado, el uso prolongado o las dosis altas de AINE pueden provocar gastritis y úlcera péptica.
La inhibición de la COX puede provocar una disminución de la agregación plaquetaria que puede agravarse por gastritis concurrente inducida por AINE o coagulopatías subyacentes.
Sin embargo, varios estudios han demostrado que no se produce un aumento del sangrado posoperatorio con el uso a corto plazo de AINE.
Los pacientes con función renal reducida o hemodinámica alterada debido a depleción aguda de volumen o enfermedad subyacente pueden correr el riesgo de lesión renal por necrosis papilar renal que conduce a una mayor disfunción renal, alteraciones electrolíticas y síndromes nefróticos o nefríticos. Aunque generalmente bien tolerado en aquellos con función renal normal, datos recientes sugieren que el ibuprofeno puede tener un efecto nefrotóxico incluso en aquellos sin enfermedad renal previa.
Estudios de múltiples AINE han sugerido un techo analgésico en dosis submáximas; por ejemplo, 400 mg VO para ibuprofeno.
No está claro si se observa un efecto antiinflamatorio adicional con dosis más altas. Una revisión Cochrane de 2015 no encontró evidencia de «diferencias clínicamente importantes en la eficacia analgésica entre los AINE y otros analgésicos VO», lo que sugiere que cualquier efecto antiinflamatorio adicional para dosis superiores al techo analgésico no tiene un efecto significativo sobre el dolor, aunque esto se basa en evidencia de baja o muy baja calidad.
El ibuprofeno y el naproxeno son los dos AINE orales más comunes utilizados para analgesia. La aspirina, aunque es un medicamento común, generalmente se evita para uso analgésico, particularmente en lesiones traumáticas, debido a sus propiedades anticoagulantes. La dosis analgésica recomendada de ibuprofeno es de 200 a 400 mg según sea necesario cada 6 h por vía oral para adultos o de 5 a 10 mg/kg para niños. En aplicaciones a corto plazo, se ha demostrado que una dosis de ibuprofeno de 1200 mg/día o menos no produce más efectos gastrointestinales adversos que el placebo en pacientes por lo demás sanos.
El naproxeno también se administra por vía oral y está disponible en tabletas de liberación inmediata y prolongada o en forma de suspensión. La dosis analgésica recomendada es generalmente una dosis de carga de 550 mg, seguida de 250 mg cada 12 h por vía oral para adultos y 5 mg/kg cada 12 h para niños (máximo 10 mg/kg/día). El meloxicam es otro AINE oral que se destaca por su uso austero, ya que su dosis analgésica recomendada para adultos es de 7,5 a 15 mg orales según sea necesario, solo una vez al día.
El ketorolaco es un AINE disponible por vía oral y parenteral, administrada por vía intravenosa o intramuscular. Los estudios no muestran diferencias en la reducción del dolor al comparar el ketorolaco intramuscular con el ibuprofeno por vía oral, aunque la presentación intramuscular puede ser útil cuando no se pueden administrar medicamentos por vía oral.
Las dosis para adultos son de 15 mg por vía intravenosa o 30 mg por vía intramuscular cada 6 h.
Los AINE tópicos, aunque han demostrado ser analgésicos eficaces, tienen un papel limitado en el tratamiento de lesiones importantes en entornos austeros, dado el mayor peso, volumen y estabilidad limitada de estas preparaciones.
Recomendación: Recomendamos los AINE como una clase eficaz de agentes analgésicos que deben emplearse como tratamiento de primera línea para el dolor leve a intenso en un entorno natural en ausencia de contraindicaciones
(recomendación fuerte, evidencia de calidad moderada).
Recomendación: Recomendamos que las estrategias de tratamiento con AINE empleen la dosis efectiva más baja durante el menor tiempo posible para minimizar los efectos adversos
(recomendación fuerte, evidencia de alta calidad).
Recomendación: Recomendamos que no se utilicen AINE en casos de disfunción renal conocida, embarazo, antecedentes de cirugía bariátrica y/o antecedentes de sangrado gastrointestinal
(recomendación fuerte, evidencia de alta calidad).
Efectos sinérgicos de los analgésicos no opioides
Se ha demostrado que las combinaciones de AINE con APAP proporcionan un control del dolor superior al de cualquiera de los fármacos solos o en combinación con un opioide oral. Los efectos secundarios son menores y la satisfacción del paciente es mayor. Estos beneficios se han observado en diversos patrones de lesiones y en pacientes posoperatorios.
Una revisión sistemática de 21 estudios a lo largo de 10 años concluyó que la combinación de APAP y un AINE fue superior a cualquiera de los fármacos por separado.
Las aplicaciones militares de combinaciones de AINE/APAP han tenido éxito.
Las unidades militares estadounidenses proporcionan a los soldados desplegados en combate un paquete de pastillas para tomar inmediatamente después de una herida penetrante en una extremidad de cualquier tipo. Estos paquetes contienen APAP, meloxicam y un antibiótico.
El dolor traumático agudo puede tratarse eficazmente con una combinación de APAP y un AINE, en muchos casos sin opioides. Para el dolor intenso, las dosis iniciales de APAP y un AINE deben ser simultáneas, tras lo cual los medicamentos deben administrarse según los intervalos de dosificación adecuados. Como base del tratamiento médico para el dolor causado por una lesión aguda, estos medicamentos deben administrarse regularmente durante el período de la lesión aguda.
Recomendación: Recomendamos que se considere una combinación de APAP/AINE en el tratamiento del dolor agudo moderado a severo en un entorno natural
(recomendación fuerte, evidencia de calidad moderada).
Analgesia con opioides
Si los primeros auxilios psicológicos, la terapia PRICE y la terapia sin opioides son inadecuados, o el dolor es suficientemente intenso, se puede considerar un aumento de los agentes analgésicos. La administración de analgesia con opioides debe realizarse con cuidado en un entorno austero, ya que el uso de opioides puede asociarse con una amplia gama de efectos secundarios, los más preocupantes son la depresión respiratoria y la pérdida de los reflejos protectores de las vías respiratorias. Otros efectos secundarios de los opioides incluyen disforia, euforia, prurito, náuseas, vómitos y estreñimiento.
No obstante, los opioides tienen un papel establecido en el tratamiento del dolor agudo intenso en entornos austeros o naturales.
La elección del opioide, la vía de administración y la dosis dependen de muchos factores, como el ámbito de la práctica, el mecanismo y la extensión de las lesiones, los problemas logísticos de la extracción y el transporte del paciente, las comorbilidades y la presencia de shock hipovolémico
La depresión respiratoria y la pérdida de los reflejos protectores de las vías respiratorias causadas por opioides siempre deben considerarse al administrar analgesia opioide, especialmente cuando se utilizan formulaciones de acción rápida o potentes. Con una titulación y administración cuidadosas por parte de médicos experimentados y otros proveedores, estos problemas generalmente se pueden evitar.
Ya sea que los opioides formen parte del plan analgésico para una expedición, uso personal o EMS en áreas silvestres, se debe considerar el manejo de las complicaciones y se debe realizar un análisis de riesgo/beneficio antes de llevar y administrar opioides. Como mínimo, los proveedores que administran analgesia opioide deben tener capacitación básica en el manejo de las vías respiratorias, ya que este es el medio principal para manejar la depresión respiratoria debido al uso de opioides.
La naloxona es un antagonista competitivo de los receptores opioides que es útil para revertir temporalmente la depresión respiratoria y la sedación debido a los opioides, pero también conlleva el riesgo de precipitar la abstinencia aguda de opioides en usuarios crónicos. Se debe considerar llevar naloxona como medicación de rescate cuando se utilizan formas más potentes de medicamentos opioides.
Recomendación: Sugerimos que la analgesia opioide puede ser un componente eficaz del tratamiento del dolor agudo en entornos naturales; sin embargo, se debe sopesar el riesgo frente al beneficio de estos medicamentos
(recomendación débil, evidencia de calidad moderada).
Recomendación: Recomendamos que los profesionales que administran analgésicos opioides estén preparados para reconocer y controlar la depresión respiratoria. Se debe considerar la disponibilidad de naloxona cuando se utilizan opioides no orales (recomendación firme, evidencia de baja calidad).
Opiáceos orales
En comparación con las preparaciones parenterales, las formulaciones orales de opioides tienen la ventaja de ser más fáciles de transportar, almacenar y administrar. Estos medicamentos son los que menos preocupación generan entre las formulaciones de opioides para la depresión respiratoria aguda y, en general, se consideran seguros para su uso sin supervisión. Sin embargo, se debe tener precaución en pacientes que no han recibido opioides, y se deben elegir opioides de acción corta en lugar de formulaciones de acción prolongada.
La durabilidad y la facilidad de administración hacen de los opioides orales una forma atractiva de analgesia para entornos austeros. Los fabricantes suelen combinar los opioides por vía oral con otros analgésicos, como APAP, para proporcionar un alivio sinérgico del dolor.
Al usar estos medicamentos combinados, se debe tener cuidado de monitorear la dosis total de ambos medicamentos. Es preferible separar los medicamentos cuando sea posible y llevar los medicamentos opioides y no opioides de forma independiente para permitir la titulación de cada medicamento. Se ha demostrado que los analgésicos no opioides por vía oral son igualmente efectivos o no inferiores a los analgésicos opioides por vía oral y los medicamentos combinados de opioides, y generalmente tienen un mejor perfil de efectos secundarios.
Este conocimiento debe motivar una consideración seria de si la analgesia opioide por vía oral proporciona algún beneficio adicional sobre los no opioides en un entorno austero. También se deben emplear primeros auxilios psicológicos, PRICE y medicamentos no opioides cuando sea apropiado para reducir el requerimiento de opioides.
Recomendación: Recomendamos que los opioides orales o las combinaciones de opioides/APAP sean eficaces para el tratamiento del dolor agudo intenso en entornos naturales. Sin embargo, los regímenes analgésicos orales sin opioides podrían ser preferibles por su eficacia equivalente y su perfil de seguridad superior
(recomendación fuerte, evidencia de calidad moderada).
Opioides intranasales, transmucosa, sublinguales y transdérmicos
Los métodos no invasivos de administración parenteral de opioides incluyen las vías IN, transmucosa (TM), SL y transdérmica (TD). El fentanilo es el opioide más utilizado para uso parenteral no intravenoso, dada su farmacocinética relativamente predecible.
El fentanilo oral generalmente es ineficaz debido a su extenso metabolismo de primer paso. Sin embargo, los opioides IN, TM y SL no están sujetos a este metabolismo y tienen la ventaja de proporcionar alivio del dolor agudo sin necesidad de acceso intravenoso. Las formulaciones TM y SL se han utilizado tradicionalmente para el tratamiento del dolor irruptivo oncológico con gran éxito.
La administración intranasal de opioides también proporciona un método para el alivio del dolor agudo sin la necesidad de acceso intravenoso. La ruta IN proporciona una rápida absorción de opioides. El fentanilo IN es el más utilizado en los servicios de urgencias, por los sistemas EMS y en entornos naturales como la atención de patrullas de esquí en montaña. También se ha descubierto que es seguro para uso pediátrico en múltiples entornos.
Los opioides IN se administran mejor en un volumen de 0,2 a 0,3 ml en cada fosa nasal.
Los volúmenes superiores a 1 ml por fosa nasal no se absorben por vía nasal, sino que se tragan y experimentan un metabolismo de primer paso. La dosis del fármaco administrada debe dividirse entre las dos fosas nasales para maximizar el área de absorción disponible y mantener los volúmenes lo más bajos posible. Los medicamentos IN se administran de forma más eficaz mediante el uso de un dispositivo atomizador.
La concentración estándar de 50 ug/ml de fentanilo IV se utiliza para administración intramuscular. Cuando se desean dosis mayores de opioides por vía intranasal, el volumen de fentanilo necesario debe administrarse en dosis múltiples a lo largo del tiempo para limitar el volumen por fosa nasal. Para superar esta limitación de volumen y proporcionar mayor analgesia en dosis pequeñas, se ha utilizado sufentanilo, un análogo del fentanilo más potente. El sufentanilo presenta una biodisponibilidad cercana al 100 % cuando se administra por vía intranasal y, a los 20 minutos, alcanza la equivalencia con dosis intravenosas similares. Se ha utilizado con éxito y seguridad en entornos clínicos y de urgencias.
El citrato de fentanilo transmucoso oral (OTFC) en pastillas libera fentanilo por absorción transmucosa. El OTFC se desarrolló originalmente para el tratamiento del dolor oncológico. El OTFC ha sido ampliamente utilizado por el ejército estadounidense y es seguro cuando se administra en dosis adecuadas en una población militar sana.
Su uso seguro en el ejército también ha dado lugar a un uso seguro y eficaz del OTFC en entornos prehospitalarios y a recomendaciones para su uso en rescates de montaña. Se ha demostrado que la administración sublingual de fentanilo tiene una farmacocinética similar a la del fentanilo IV.
Recientemente, el sufentanilo SL ha sido aprobado para el tratamiento del dolor agudo en pacientes que nunca han recibido opiáceos en un entorno monitoreado, desarrollado con el apoyo del Departamento de Defensa de los Estados Unidos para proporcionar un método no intravenoso de control del dolor en el campo de batalla. La formulación SL es segura y eficaz y tiene un perfil eufórico y de efectos secundarios reducido en comparación con el fentanilo.
Los estudios sobre el uso del sufentanilo SL se han limitado a entornos de urgencias y hospitales, pero los estudios agrupados de 436 y 806 pacientes sugieren que es seguro y eficaz en entornos de atención médica monitoreados.
Aún no se han publicado estudios sobre el uso prehospitalario. Los opioides transdérmicos están diseñados para el control del dolor a largo plazo en personas con tolerancia a los opioides y su utilidad en entornos naturales es limitada debido a su lento inicio de acción. Debido a la escasez de evidencia para el tratamiento del dolor agudo, no se recomienda su uso en entornos austeros.
Recomendación: Recomendamos la OTFC para el tratamiento seguro y eficaz del dolor en entornos naturales
(recomendación fuerte, evidencia de calidad moderada).
Recomendación: Recomendamos el fentanilo intranasal para un control del dolor seguro y eficaz en entornos naturales
(recomendación fuerte, evidencia de calidad moderada).
Recomendación: Sugerimos que, a pesar del uso prehospitalario limitado documentado, el fentanilo y el sufentanilo sublinguales probablemente sean seguros y efectivos para uso natural , siempre que se pueda realizar un seguimiento del paciente
(recomendación débil, evidencia de calidad moderada).
Opioides intravenosos, intramusculares e intraóseos
La administración intravenosa de opioides puede proporcionar una analgesia rápida y eficaz.
Sin embargo, obtener y mantener un acceso intravenoso puede ser difícil en entornos naturales, ya que requiere habilidades adecuadas, equipo adecuado y mantenimiento continuo. Factores ambientales como el frío o las temperaturas gélidas también pueden influir en la decisión de optar por un acceso intravenoso.
Los opioides intravenosos conllevan una mayor carga regulatoria y de licencias, y quedan fuera del alcance de la práctica de muchos profesionales médicos de montaña. La disponibilidad de medicamentos intravenosos puede ser más razonable dentro de los sistemas de servicios médicos de emergencia (SME) organizados en áreas silvestres o en campamentos base de expediciones, donde pueden ocurrir estancias prolongadas y evacuaciones retrasadas.
Se deben considerar las posibles complicaciones del uso de opioides parenterales, y todos los profesionales que administren estos medicamentos deben ser competentes en el manejo básico de la vía aérea.
La naloxona puede considerarse como medicación de rescate. El acceso intraóseo (IO) es una vía alternativa que se establece más fácilmente en ciertas situaciones y debe considerarse cuando se necesita acceso IV y no puede obtenerse fácilmente.
Las vías IV e IO tienen varias ventajas sobre la vía PO: brindan un alivio rápido del dolor y una administración confiable de medicamentos, son titulables y pueden ser un modo de administración familiar para los profesionales de la salud. El fentanilo se ha recomendado como el fármaco de elección para el control del dolor intravenoso prehospitalario en el ámbito de los SEM.
En entornos naturales o de alta montaña, podría preferirse un opioide de acción prolongada. Si bien la naturaleza invasiva de la vía intravenosa la hace poco práctica en muchos entornos naturales, una vez establecido el acceso intravenoso/io, estos medicamentos aún se consideran el estándar de oro para el control del dolor agudo e intenso.
La vía intramuscular evita la necesidad de establecer un acceso intravenoso o io, pero debido a la absorción variable, el inicio de acción y la eficacia pueden ser inferiores. El fentanilo intramuscular y la morfina se han comparado prospectivamente y se ha demostrado que son equivalentes en términos de analgesia y efectos secundarios cuando se administran en dosis equipotentes.
Recomendación: Recomendamos que se utilicen opioides parenterales para proporcionar analgesia para el dolor agudo intenso en entornos naturales cuando los beneficios superan los riesgos y cuando las modalidades más conservadoras no proporcionan analgesia suficiente
(recomendación fuerte, evidencia de calidad moderada).
Ketamina
La ketamina es un agente anestésico disociativo que es un antagonista del N-metil-D-aspartato (NMDA) que se sospecha que bloquea los efectos aferentes de la percepción del dolor en la formación reticular medular, altera ciertos sistemas transmisores del SNC y suprime la actividad de la médula espinal.
En la formulación común, la ketamina es una mezcla racémica 50:50 de s- y r -ketamina. El enantiómero ketamina es un agente analgésico más potente y, en dosis subdisociativas, tiene menos efectos secundarios psiquiátricos que la mezcla racémica, lo que ha llevado a su creciente uso como analgésico en algunos países.
Aquí se analiza la forma racémica más ampliamente disponible En dosis bajas, la ketamina tiene un largo historial de uso prehospitalario para el dolor agudo. La ketamina se puede administrar por diversas vías, como IM, IV/IO, IN, PO, SL y PR.
La mayoría de las aplicaciones en áreas silvestres se realizan por vía IM, IN y IV/IO. La ketamina es única entre los medicamentos para el control del dolor, ya que tiene efectos variables en diferentes dosis, y se debe tener cuidado de permanecer dentro del rango de «dosis de dolor» o «dosis baja» de ketamina (0,1-0,5 mg/kg IV o 1-2 mg/kg IM).
En dosis más altas (1-2 mg/kg IV o 3-5 mg/kg IM), la ketamina causa disociación, un tipo de sedación moderada que a menudo se emplea en el uso hospitalario.
Entre estos rangos de dosificación, la ketamina puede causar alucinaciones, euforia/disforia, delirio y otros efectos indeseables. Para el control del dolor, la ketamina se administra dentro del rango de dosis baja mencionado anteriormente mediante inyección intravenosa lenta, infusión intravenosa o inyección intramuscular.
Si se administran dosis repetidas, se debe tener cuidado para evitar la redosificación rápida y la inducción de alucinaciones o sedación. La ketamina se puede usar de forma segura en combinación con opioides para mejorar el control del dolor si se requieren múltiples modalidades.
La ketamina es bien tolerada y se ha demostrado que es segura cuando se administra en dosis disociativas por profesionales no médicos para facilitar los procedimientos, lo que refuerza su seguridad cuando se usa en dosis para el control del dolor.
Se ha reportado que la ketamina es segura y útil, y presenta pocos efectos adversos asociados cuando es utilizada por médicos que trabajan en un servicio de rescate médico aéreo en montaña.
También se ha utilizado de forma segura en dosis disociativas para procedimientos a gran altitud (>3900 m) por médicos de atención primaria sin formación en anestesiología. Esta aplicación en 11 casos no reveló complicaciones significativas ni hipoxia asociadas con el uso de ketamina. Con dosis de dolor adecuadamente ajustadas, los pacientes pueden mantener su propia vía aérea, ya que los reflejos faríngeos y la ventilación espontánea suelen estar preservados. Sin embargo, la salivación suele aumentar y se ha reportado obstrucción de la vía aérea con dosis disociativas.
A diferencia de muchos agentes anestésicos y analgésicos, la función cardiovascular suele estar bien preservada en el contexto de la administración de ketamina. Esto convierte a la ketamina en una opción adecuada para pacientes con trauma si se sospecha shock hemorrágico.
Recomendación: Recomendamos la ketamina para el control del dolor agudo intenso en un entorno natural, utilizando dosis analgésicas (0,1–0,5 mg/kg IV, 1–2 mg/kg IM). Los profesionales sanitarios deben tener experiencia en el uso del medicamento y estar capacitados para manejar las complicaciones de la vía aérea en caso de que surjan (recomendación firme, evidencia de calidad moderada).
Anestésicos locales
Los anestésicos locales (AL) actúan prolongando la desactivación de los canales de sodio dependientes de voltaje. Al actuar sobre las neuronas periféricas, reducen o bloquean reversiblemente la transmisión neuronal, lo que produce analgesia local o anestesia. Sin embargo, al absorberse sistémicamente, estos medicamentos pueden causar efectos adversos graves al actuar sobre los canales de sodio del miocardio o del SNC, como paro cardíaco y convulsiones. Por lo tanto, se debe prestar atención a las dosis máximas basadas en el peso para evitar la toxicidad (p. ej., lidocaína 4-5 mg/kg, máximo 300 mg/dosis y 2400 mg/día), y se debe tener cuidado para evitar la inyección intravascular o intraneural.
A nivel mundial, los anestésicos locales (AL) más utilizados son la lidocaína (lignocaína) y la bupivacaína, aunque existen numerosas variaciones y preparaciones dentro de esta categoría. El inicio, la duración de la acción y la densidad de la analgesia o anestesia local producida por los AL dependen de múltiples factores farmacológicos, como la liposolubilidad, la constante de disociación, la concentración y la dosis total. Normalmente, los agentes con un inicio de acción más rápido tienden a tener una duración de acción más corta, mientras que los fármacos de acción más prolongada conllevan un mayor riesgo de toxicidad.
Los LA se pueden aplicar tópicamente sobre la piel o las membranas mucosas, inyectarse directamente en los tejidos periféricos o adyacentes a los nervios regionales o incluso a la médula espinal para producir analgesia o anestesia regional o neuroaxial.
Anestesia local tópica
Los agentes anestésicos tópicos se aplican directamente sobre o alrededor de los sitios periféricos de nocicepción en forma de gel, líquido, ungüento o crema, bloqueando los estímulos nocivos en su origen.
La administración es sencilla y la baja absorción sistémica reduce el riesgo de efectos secundarios.
Existen numerosas formulaciones de anestésicos disponibles para uso tópico, incluyendo productos combinados y formulaciones viscosas para facilitar su aplicación (p. ej., lidocaína/epinefrina/tetracaína [LET] y la mezcla eutéctica de lidocaína/prilocaína [EMLA]). Se ha demostrado la eficacia y seguridad de estas formulaciones para el tratamiento de heridas y picaduras, así como para facilitar la reparación de laceraciones.
No se ha estudiado la eficacia de estas formulaciones fuera de las temperaturas de almacenamiento recomendadas de 0 a 30 °C, lo que podría limitar su uso en algunos entornos austeros
Recomendación: Recomendamos agentes anestésicos locales instilados y aplicados tópicamente para el tratamiento seguro y eficaz del dolor relacionado con quemaduras, picaduras y lesiones de tejidos blandos en entornos naturales
(recomendación fuerte, evidencia de calidad moderada).
Soluciones oftálmicas/óticas
Las soluciones oftálmicas y óticas de anestésicos tópicos son útiles en el tratamiento de afecciones como abrasiones o ulceraciones corneales, queratitis ultravioleta, otitis media y otitis externa.
Estas preparaciones se diferencian de las soluciones acuosas simples de anestésicos locales en que a menudo contienen conservantes, tampones, agentes viscosizantes y otros aditivos para hacerlas más efectivas y tolerables en la zona de acción.
A falta de alternativas, se puede utilizar una solución acuosa de lidocaína, como la utilizada para la infiltración local, en la aplicación tópica ocular. Sin embargo, la falta de tamponamiento del pH reduce la penetración en la película lagrimal y causa una incomodidad significativa durante la instilación, lo que reduce la eficacia y la tolerabilidad.
Las soluciones oftálmicas y óticas suelen tener una composición similar, aunque las soluciones oftálmicas son estériles y no contienen partículas, por lo que las soluciones oftálmicas pueden instilarse en el oído, pero las soluciones óticas no deben utilizarse en el ojo. Las soluciones óticas suelen ser más económicas.
Las soluciones oftálmicas pueden ser de gran utilidad en el cuidado de un paciente debilitado por una abrasión corneal o queratitis, ya que la analgesia puede facilitar la apertura ocular y permitir que el paciente participe en su evacuación. La preocupación por el retraso en la cicatrización corneal ha llevado a muchos profesionales a suspender su uso repetido en el contexto de una lesión corneal.
Sin embargo, un metaanálisis que agrupó dos estudios prospectivos aleatorizados en el servicio de urgencias no mostró efectos adversos clínicamente significativos con el uso repetido de proparacaína oftálmica durante menos de 72 h.
Por consiguiente, es razonable utilizar un tratamiento corto de anestésicos oftálmicos para facilitar la evacuación de pacientes que, de otro modo, estarían debilitados. Debido a la reducida capacidad de automonitoreo, se debe tener cuidado de proteger el ojo anestesiado de agresiones, como la sequedad o la exposición a cuerpos extraños o a la radiación UV.
Recomendación: Sugerimos que las soluciones anestésicas oftálmicas son, cuando se utilizan adecuadamente, seguras y útiles para el tratamiento del dolor ocular y auricular agudo en entornos naturales
(recomendación fuerte, evidencia de baja calidad).
Analgesia regional
La analgesia regional emplea la inyección de anestésico local cerca y alrededor de los nervios o plexos nerviosos para lograr amplias áreas de analgesia y anestesia. El uso de analgesia/anestesia regional en un entorno austero tiene el potencial de cumplir muchos objetivos del manejo austero del dolor, como evitar la sedación, la depresión respiratoria, la inestabilidad cardiovascular y otros efectos secundarios no deseados.
La anestesia regional también utiliza una cantidad limitada de equipo compacto para proporcionar un inicio rápido y predecible de un excelente control del dolor. Sin embargo, estos enfoques requieren equipo adicional, agentes farmacológicos, capacitación y experiencia. Por lo tanto, la selección del paciente, el entorno y la técnica debe considerarse cuidadosamente.
Es poco probable que las inyecciones neuroaxiales (intratecales/espinales y epidurales) sean adecuadas para condiciones austeras fuera de circunstancias específicas y, por lo tanto, quedan fuera del alcance de estas pautas.
Bloqueos regionales prácticos
A diferencia de las técnicas neuroaxiales, la anestesia y la analgesia regionales se pueden lograr en muchos entornos con un equipo mínimo y una capacitación limitada, manteniendo al mismo tiempo un margen de seguridad aceptable.
Los bloqueos nerviosos bien ejecutados pueden proporcionar una analgesia excelente y duradera o una anestesia completa de una extremidad o región para permitir intervenciones e incluso la movilización y el autorrescate. Sin embargo, estas ventajas deben equilibrarse con la seguridad; los bloqueos nerviosos también pueden dificultar el autorrescate o inutilizar una extremidad durante horas
El concepto de bloqueos regionales convenientes para el campo (FERB) se refiere a técnicas de bloqueo nervioso que:
•Tener enfoques consistentes utilizando puntos de referencia anatómicos fiables;
•Puede realizarse de forma fiable con una distribución del efecto predecible;
•Evitar estructuras que conlleven alto riesgo o consecuencias de lesión (por ejemplo, pleura o vasos principales);
•Tienen un bajo riesgo de efectos no deseados (por ejemplo, bloqueo del nervio frénico y parálisis diafragmática, que frecuentemente acompaña al bloqueo del plexo braquial interescalénico);
•Exigir volúmenes de medicamento que estén dentro de la dosis máxima segura del LA seleccionado;
•Tienden a una absorción más lenta del fármaco, reduciendo el riesgo de toxicidad sistémica;
•Se aprenden fácilmente y pueden ser practicados por profesionales de la medicina austera que trabajan en una variedad de entornos para volverse competentes antes de usarlos en el campo;
•No requiere equipo altamente especializado.
Si bien una discusión completa de los FERB adecuados está más allá del alcance de estas pautas, los ejemplos del concepto incluyen ciertos bloqueos orbitarios, dentales y occipitales en la cabeza y el cuello; bloqueos coracoides, de muñeca e interdigitales en la extremidad superior; el bloqueo del plano de la fascia ilíaca, bloqueos poplíteos, peroneos, de tobillo e intermetatarsianos en la extremidad inferior; y el bloqueo en anillo de cualquier dedo.
La ecografía se ha convertido en el estándar de atención hospitalaria para muchos bloqueos regionales y es obligatoria para algunas técnicas. Permite la visualización de planos tisulares, nervios, vasos sanguíneos y otras estructuras con mínimas molestias y tiene muchos otros usos en la medicina austera.
Sin embargo, la ecografía requiere formación y práctica adicionales para su uso eficaz en bloqueos regionales, que deben obtenerse en un entorno controlado.
Los profesionales deben conocer los posibles riesgos y complicaciones de los bloqueos nerviosos regionales y, siempre que sea posible, solicitar el consentimiento del paciente antes de realizar un bloqueo. Es fundamental conocer los signos, síntomas y el manejo de la toxicidad sistémica por anestésicos locales (LAST).
Se debe obtener acceso intravenoso antes de todos los bloqueos, excepto los más sencillos, para facilitar el tratamiento de las complicaciones según sea necesario, y siempre se debe disponer de equipo y fármacos para la reanimación antes de iniciar un bloqueo regional. Por lo tanto, estas técnicas están limitadas a equipos de rescate y personal de respuesta bien equipados y capacitados.
Recomendación: Sugerimos que cuando son realizados por profesionales experimentados con el equipo de administración y monitoreo necesario, los bloqueos nerviosos regionales prácticos en el campo pueden ser una herramienta eficaz para controlar el dolor y facilitar los procedimientos en un entorno natural
(recomendación débil, evidencia de baja calidad).
Recomendación: Recomendamos que se utilicen ecógrafos portátiles para las FERB en entornos naturales cuando se disponga de equipos y habilidades adecuados (recomendación fuerte, evidencia de calidad moderada).
Atención de pacientes con bloqueos nerviosos en el entorno natural
La analgesia local y regional puede facilitar (pero no debe retrasar) las intervenciones que salvan la vida y la extremidad. Una analgesia regional bien ejecutada puede mejorar la capacidad del paciente para comunicarse o participar en actividades de autocuidado y autorrescate, pero no exime de la responsabilidad de realizar un seguimiento y una evaluación continuos.
Se debe prestar especial atención a la evaluación de los síntomas y signos de LAST y al cuidado de la región bajo analgesia/anestesia para prevenir lesiones mayores. Es posible que los pacientes con bloqueos bien ejecutados no puedan sentir los puntos de presión, controlar una extremidad anestesiada o percibir una perfusión inadecuada debido al síndrome compartimental, apósitos o medidas de inmovilización demasiado restrictivas.
Recomendaciones: Recomendamos inmovilización con acolchado adecuado, cuidados de presión y evaluaciones frecuentes de perfusión y ausencia de signos clínicos de síndrome compartimental según sea necesario para pacientes que han recibido bloqueos regionales en entornos naturales
(recomendación fuerte, evidencia de baja calidad).
Bloqueos de hematomas
A diferencia de todas las demás técnicas modernas de analgesia regional, el bloqueo hematoma busca aspirar deliberadamente la sangre mediante el avance de una aguja de calibre 20 G directamente en el hematoma que rodea la fractura, utilizando una técnica estéril. Se utiliza casi exclusivamente para la reducción de fracturas distales de radio/cúbito, aunque también se ha descrito su uso para fracturas de tibia.
Dado que los hematomas de fractura pueden considerarse contiguos al espacio medular, la absorción de anestésicos locales a través del hematoma podría ser, en teoría, tan rápida como la administración intraósea de fármacos. Por esta razón, para este bloqueo solo se utiliza lidocaína, a una dosis máxima de 1,5-2 mg/kg. Para la mayoría de los pacientes adultos, un volumen de 5-10 ml de solución de lidocaína al 1 % es seguro y eficaz.
Recomendaciones: Sugerimos que los bloqueos de hematomas con lidocaína simple pueden ser realizados por profesionales con la experiencia adecuada en entornos naturales
(recomendación débil, evidencia de calidad moderada).
Infiltración en entornos naturales de anestésicos locales
Aunque no constituye un verdadero bloqueo regional, la infiltración de anestésicos locales (AL) alrededor de los márgenes de una herida o en una región lesionada es un método eficaz para administrar analgesia y puede extenderse a la anestesia locorregional para procedimientos. En este contexto, el uso de AL concentrado ofrece pocas ventajas, y diluciones de lidocaína del 0,5 % al 1 % y tan solo el 0,1 % de agentes de acción prolongada pueden ser eficaces.
El uso de una aguja de calibre estrecho y la inyección con retirada suave y continua reducen el riesgo de inyección intravascular. Se debe tener precaución al calcular la dosis máxima segura, especialmente al administrar inyecciones repetidas en un período limitado.
Recomendaciones: Recomendamos la infiltración de campo de LA diluido para el tratamiento seguro del dolor agudo debido a heridas de tejidos blandos en entornos naturales
(recomendación fuerte, evidencia de calidad moderada).
Infiltración de difenhidramina
La difenhidramina (DPH) es un antihistamínico que es un agonista inverso en el receptor H1. Por lo general, se emplea en el tratamiento de la alergia o la anafilaxia y puede llevarse como un componente de botiquines médicos de entornos naturales por esta razón. Si bien las formulaciones orales de DPH se limitan a estas indicaciones tradicionales, una formulación acuosa de DPH al 1% diluida del 5% típica para uso intravenoso también es útil como un LA, particularmente en aquellos pacientes con alergias a los LA típicos como la lidocaína. La inyección local de DPH al 1% logra una analgesia adecuada para el cuidado de heridas en 5 minutos en el 80% de los pacientes.
En comparación con la lidocaína, la inyección de DPH es más dolorosa, el efecto analgésico ligeramente menor que el de la lidocaína pero adecuado para la sutura y el cuidado de heridas, y la analgesia de DPH tiene una duración más corta que la de la lidocaína.
La infiltración de DPH puede causar sedación leve dosis-dependiente, lo cual debe tenerse en cuenta si se espera que el paciente deambule o participe en auto-rescate.
Los posibles efectos adversos de la inyección intraarterial de DPH son mínimos, especialmente en comparación con la lidocaína. La infiltración local de DPH puede, en raras ocasiones, causar irritación cutánea. Hasta la fecha, no se ha estudiado el uso de DPH en bloqueos nerviosos, regionales y de hematomas.
Recomendación: Recomendamos la solución acuosa de DPH por su seguridad y eficacia para la infiltración local y el cuidado de heridas como alternativa a la lidocaína en entornos naturales cuando esta no está disponible o la alergia limita su uso. Se debe considerar su efecto sedante
(recomendación firme, evidencia de calidad moderada).
Lidocaína intravenosa
El uso de lidocaína intravenosa como infusión para el tratamiento del dolor se ha reportado ampliamente en aplicaciones hospitalarias y ha mostrado un efecto equivalente en relación con los opioides en algunas aplicaciones, así como efectos ahorradores de opioides.
Sin embargo, las guías de anestesia describen el uso de lidocaína intravenosa como de «alto riesgo» incluso en el entorno hospitalario debido a su estrecha ventana terapéutica.
En la aplicación hospitalaria, el acceso a la terapia de emulsión lipídica se considera necesario para tratar una posible sobredosis. En una revisión sistemática de su uso en la aplicación hospitalaria, de 289 pacientes tratados con lidocaína intravenosa, se reportaron 44 eventos adversos, de los cuales 36 (12.4%) fueron «graves», incluyendo alteración del estado mental y arritmias cardíacas.
Un metaanálisis de su uso en el servicio de urgencias arrojó tasas de eventos adversos similares, pero mostró un rendimiento equívoco en comparación con los opioides.
Se dispone de un informe de caso que describe a dos pacientes tratados con lidocaína intravenosa en un entorno austero. Ambos pacientes experimentaron una mejoría del dolor; sin embargo, ambos fueron tratados sin la disponibilidad de emulsión lipídica y ambos experimentaron síntomas prodrómicos de LAST.
Esto resalta el riesgo de emplear este método sin recursos hospitalarios. Debido al grado de monitorización y equipo de reanimación requeridos, y dado el bajo índice terapéutico de este método, no se recomienda el uso intravenoso de anestésicos locales.
Recomendación: Recomendamos que no se utilice lidocaína IV en entornos naturales (recomendación fuerte, evidencia de baja calidad).
Analgésicos inhalatorios
La analgesia inhalatoria se proporciona al respirar gases específicos o agentes volátiles que inducen efectos analgésicos tras su absorción en el pulmón. Esto debe distinguirse de la administración tópica/TM de agentes mediante atomización o nebulización.
La analgesia inhalatoria se caracteriza por un inicio y fin rápidos del efecto, facilidad de administración, ausencia de necesidad inmediata de acceso intravenoso y una eficacia comparable a la de otros agentes sistémicos. Actualmente, solo existen dos analgésicos inhalatorios en uso clínico: el óxido nitroso (un gas) y el metoxiflurano (un vapor). Ambos requieren equipos y métodos específicos para su administración, que se describen más adelante.
Óxido nitroso
El óxido nitroso (N2O ) es un gas incoloro, no inflamable, con un aroma ligeramente dulce que tiene propiedades anestésicas eufóricas y disociativas a altas presiones parciales y una analgesia significativa a dosis más bajas. El N2O se autoadministra típicamente respirando a través de una válvula a demanda y una boquilla que se sostiene entre los dientes o directamente a través de una mascarilla facial anestésica. El inicio de acción es rápido, en varias respiraciones; la analgesia clínicamente significativa ocurre en 5 minutos.
Si bien el mecanismo de acción preciso no se comprende completamente, es probable que los efectos anestésicos se deban al antagonismo no competitivo del receptor central NMDA, mientras que los efectos analgésicos están mediados por la liberación endógena de opioides en el mesencéfalo.
Se usa comúnmente como agente sinérgico durante la inducción y el mantenimiento de la anestesia general, pero también se ha administrado ampliamente en combinación con oxígeno (O2 ) como analgésico para afecciones y procedimientos dolorosos, como el parto o el trabajo dental Fuera del quirófano, se encuentra disponible con mayor frecuencia en una mezcla premezclada (50 %) con oxígeno, conocida como Entonox. El N₂O también puede mezclarse con un suministro separado de O₂ puro mediante una licuadora, aunque esto resulta más engorroso para el uso prehospitalario.
El N₂O se ha utilizado con considerable éxito como analgésico en la atención prehospitalaria durante muchos años. Se ha demostrado que la analgesia con N₂O administrada al paciente presenta una baja tasa de eventos adversos y sedación tanto en niños como en adultos.
Los efectos secundarios más comunes, como náuseas, mareos y sedación leve, suelen ser de corta duración. A dosis analgésicas, presenta estabilidad cardiovascular y ausencia de depresión respiratoria, y puede proporcionar una analgesia equivalente a la administración sistémica de opiáceos.
La rápida difusión del N₂O puede provocar acumulación en espacios gaseosos dentro del cuerpo, por lo que debe usarse con precaución en víctimas de traumatismo craneoencefálico o torácico para no agravar el neumotórax o el neumoencéfalo, y su uso está contraindicado en buzos recién ascendidos.
Existen tres limitaciones importantes para el uso de N₂O entornos naturales. En primer lugar, se almacena en cilindros presurizados, voluminosos y pesados (p. ej., Entonox), que requieren el uso de reguladores y una válvula de demanda, lo que dificulta su transporte y almacenamiento.
En segundo lugar, la naturaleza de la mezcla de gases presurizados reduce el rango de temperaturas ambientales en las que se puede utilizar. La luz solar directa y las altas temperaturas pueden provocar la ruptura del cilindro debido a la sobrepresión, y las temperaturas bajo cero (inferiores a -5,5 °C) provocarán la licuefacción del N₂O. Inicialmente, esto puede resultar en la inhalación de oxígeno con N₂O limitado en concentraciones impredecibles. Sin embargo, a medida que el cilindro se vacía, se administra una concentración creciente de N₂O y la mezcla se vuelve peligrosamente hipóxica.
Por consiguiente, las mezclas de N₂O / O₂ deben administrarse con precaución a temperaturas bajo cero. En tercer lugar, el N₂O se administra en forma de gas, y el aumento de la altitud provocará una disminución correspondiente en la presión parcial inhalada de los gases. Esto, a su vez, disminuye el efecto analgésico del N₂O en altitud.
Por lo tanto, si bien es un agente útil a nivel del mar, el valor del N₂O disminuye considerablemente a gran altitud.
Además, el N₂O puede acumularse en espacios pequeños y mal ventilados, por lo que se debe garantizar una ventilación adecuada para evitar la inhalación accidental entre las personas presentes.
Estas restricciones sobre la portabilidad del agente y su uso en condiciones adversas han desalentado su uso en entornos naturales . Si bien el N₂O se ha empleado en patrullas de esquí en Canadá, Australia y Estados Unidos, no se ha informado sobre su uso en pistas de esquí, ni sobre su eficacia y seguridad.
Recomendación: Sugerimos el
N₂O como analgésico seguro y eficaz en entornos naturales para procedimientos breves y dolorosos o por periodos limitados. Si bien la evidencia sobre su uso en entornos naturales es limitada, puede utilizarse con seguridad a baja altitud, con la monitorización adecuada y siempre que se pueda garantizar el almacenamiento adecuado de los cilindros (recomendación débil, evidencia de baja calidad).
Metoxiflurano
El metoxiflurano es un anestésico volátil halogenado con propiedades analgésicas.
Su mecanismo de acción no se conoce bien, pero es un agonista conocido del receptor GABA y reduce la función de las uniones comunicantes en el cerebro. Aunque ya no se utiliza para anestesia, se ha utilizado ampliamente como analgésico en Australia y Nueva Zelanda por personal de primeros auxilios paramédico, militar y civil durante más de 30 años.
El metoxiflurano se autoadministra por inhalación a través de un dispositivo portátil con forma de silbato que funciona como un vaporizador desechable de aspiración. El inicio de la analgesia es rápido (en 5 min) y continúa mientras el paciente respira a través del dispositivo.
Cuando se usa de forma continua, una dosis única (3 ml) dura aproximadamente 25-30 min.
Sus efectos se revierten rápidamente al suspender la inhalación. Los cambios en la función cardiovascular, respiratoria y neurológica durante la administración de metoxiflurano no son clínicamente significativos y, por lo tanto, el acceso intravenoso no es esencial.
Los efectos secundarios más comunes son mareos, dolor de cabeza y sensación de somnolencia.
Los efectos adversos graves son raros, pero el metoxiflurano está contraindicado en pacientes con insuficiencia renal o hepática, así como en aquellos que tienen antecedentes personales o familiares de hipertermia maligna.
Se ha planteado la inquietud de si el metoxiflurano sufrirá la misma disminución de eficacia en altitud que la experimentada con el N₂O.¹97 Sin embargo , dado que la presión de vapor saturado no se ve afectada por la presión ambiental, la altitud no debería afectar la presión parcial suministrada por el dispositivo, una teoría confirmada en trabajos de laboratorio iniciales.¹86.
Quedan por estudiar el efecto de las bajas temperaturas ambientales en el rendimiento del dispositivo y si los factores ambientales influyen en la eficacia clínica del metoxiflurano en el campo. La eficacia para la analgosedación a gran altitud (4470 m) parece mantenerse en un estudio de caso.
Se ha demostrado que el metoxiflurano tiene un inicio de acción más rápido y una analgesia inicial comparable o mejor en comparación con los opiáceos intravenosos o APAP.
Además, su portabilidad, estabilidad y facilidad de administración lo hacen muy adecuado para su uso en entornos austeros.
El inicio de acción rápido y el perfil de efectos secundarios limitado hacen que el metoxiflurano sea útil como medida temporal hasta que se puedan establecer otras modalidades o como analgésico definitivo a corto plazo.
Recomendación: Recomendamos el metoxiflurano como seguro y efectivo para tratar el dolor en dosis subanestésicas en entornos naturales
(recomendación fuerte, evidencia de calidad moderada).
Datos complementarios
Benzodiazepinas
Las benzodiazepinas (BZD), utilizadas desde hace tiempo para el tratamiento de la ansiedad, se han recomendado previamente como posible analgésico complementario.
Esto era lógico, ya que, como se ha comentado previamente, existe una correlación entre los estados de ansiedad y una mayor percepción del dolor agudo. Sin embargo, no existe evidencia sólida que respalde la administración de BZD para la analgesia. Las BZD actúan a nivel central sobre los receptores GABA-A, lo que provoca depresión del SNC.
Además, la combinación de BZD con otros depresores del SNC puede potenciar sus preocupantes efectos adversos. La combinación de BZD con opioides ha sido ampliamente estudiada y tiene el potencial de inducir depresión respiratoria significativa.
Recomendación: Recomendamos que las BZD no se utilicen para el tratamiento del dolor en entornos naturales
(recomendación fuerte, evidencia de alta calidad).
Otras fármacos y técnicas
Se han estudiado diversas clases de medicamentos y técnicas adicionales como complementos para el dolor, tanto en el ámbito hospitalario como ambulatorio.
Estos incluyen antihistamínicos, acupuntura de campo de batalla, antipsicóticos, relajantes musculares no BZD, capsaicina y antidepresivos.
Si bien existe evidencia heterogénea, pero generalmente favorable, para el uso de estos medicamentos en el tratamiento a largo plazo del dolor crónico, no existe evidencia suficiente que respalde su uso para el tratamiento del dolor agudo en un entorno austero, por lo que no se puede recomendar su uso en condiciones en entornos naturales.
Conclusión
En todos los casos, la comodidad del paciente debe equilibrarse con el riesgo de cualquier herramienta utilizada para abordar el dolor. En comparación con la medicina hospitalaria o de los SEM, la evidencia sobre las modalidades de control del dolor específicas para entornos naturales es generalmente limitada.
Por consiguiente, la experiencia del personal de respuesta, la consideración de los recursos disponibles y el juicio clínico son fundamentales para la selección de las modalidades de control del dolor adecuadas para el paciente y el entorno. Algunas intervenciones pueden permitir al paciente participar en su propio rescate, mientras que otras pueden generar un riesgo inaceptable para el paciente o el equipo.
Tanto los profesionales de la recreación en zonas agrestes, como los guías de expediciones y los rescatistas profesionales deben considerar los recursos, los riesgos y las limitaciones específicos de sus entornos y planificar las modalidades adecuadas para el manejo del dolor agudo, así como la capacitación, los monitores, el equipo y los antídotos necesarios para gestionar los riesgos de dichas intervenciones. La escasez de investigación específica en entornos naturales también abre numerosas oportunidades para estudios adicionales.
Infografía Tratamiento del dolor agudo en entornos naturales

Artículo original
Autores
Dr. Patrick B. Finkpatrickfinkmd@gmail.com, Albert R. Wheeler , III, MD , y David Weber , FP-C, William R. Smith , doctor en medicinahttps://orcid.org/0000-0002-1223-4168, Graham Brant-Zawadzki , MD, MPHhttps://orcid.org/0000-0001-7842-8822, James R. Lieberman , MD, Scott E. McIntosh , doctor en medicina, máster en salud pública, Dr. Christopher Van Tilburg, Ian S. Wedmore , MD, Jeremy S. Windsor , MD, Ross Hofmeyr , MMedhttps://orcid.org/0000-0002-9990-7459
https://doi.org/10.1177/10806032241248422









Deja un comentario